
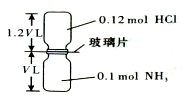
 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
分析 氨气与HCl反应方程式为:HCl+NH3=NH4Cl,二者反应生成0.1mol氯化铵固体,剩余0.02molHCl,
A.容器的容积固定,反应后瓶内压强与气体的物质的量成正比;
B.根据m=nM计算出装置中H元素的总质量;
C.反应后生成0.1mol氯化铵;
D.依据瓶内外压强差解答;
解答 解:氨气与HCl反应方程式为:HCl+NH3=NH4Cl,二者反应生成0.1mol氯化铵固体,剩余0.02molHCl,
A.反应前两瓶内压强相同,反应后两瓶内压强仍然相同,反应后两瓶内压强为反应前的:$\frac{0.2mol}{0.12mol+0.1mol}$=$\frac{1}{11}$,故A错误;
B.根据质量守恒可知,装置中含有H原子的总物质的量为:0.12mol+0.1mol×3=0.42mol,质量为:1g/mol×0.42mol=0.42g,故B正确;
C.反应后生成0.1mol氯化铵,氯化铵为离子化合物,不存在氯化铵分子,故C错误;
D.反应后瓶内压强小于外界大气压,所以反应结束后,两个集气瓶不容易分开,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗应用及计算,题目难度中等,明确物质的性质及发生反应,熟悉阿伏伽德罗定律是解题关键,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:多选题
| A. |  长时间看到Fe(OH)2白色沉淀 | B. | 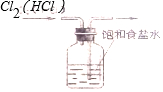 除去Cl2中的HCl杂质 | ||
| C. | 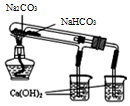 比较NaHCO3、Na2CO3的热稳定性 | D. | 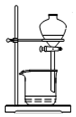 分离碘酒中的碘和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
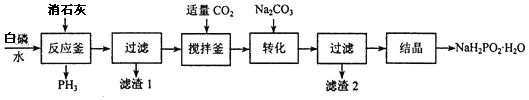
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入氯化钡溶液有白色沉淀生成,且沉淀不溶于稀盐酸,则原溶液一定含有SO42- | |
| B. | 某溶液中加入盐酸放出能使澄清的石灰水变浑浊的无色无味的气体,则原溶液一定含有CO32- | |
| C. | 检验某溶液中是否含有Fe3+时,可滴加硫氰化钾溶液,若溶液由无色变为血红色,则说明溶液中一定含有Fe3+ | |
| D. | 某溶液进行焰色反应,火焰颜色呈黄色,说明原溶液中一定不存在钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00 mL 时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
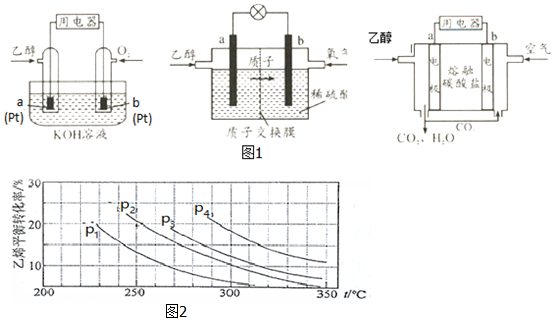
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别取两种固体样品,加热产生气体的是碳酸氢钠 | |
| B. | 分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠 | |
| C. | 分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠 | |
| D. | 分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ③②④① | D. | ①④②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com