
| A. | 化石燃料的开采和使用可以解决能源危急 | |
| B. | 国家积极推广使用节能环保材料利于环境保护 | |
| C. | 探索太阳能、氢能、地热能、海洋能和生物能的生物能的使用对解决能源危急有重要意义 | |
| D. | 化学反应过程中同时存在着物质和能量的变化 |
分析 A.化石燃料为不可再生资源,大量的开采和使用会引发环境问题;
B.国家积极推广使用节能环保材料利于环境保护;
C.探索太阳能、氢能、地热能、海洋能和生物能等新型能源对解决能源危急有重要意义;
D.化学反应伴随着物质和能量的变化.
解答 解:A.化石燃料为不可再生资源,大量的开采和使用会引发环境问题,故A错误;
B.国家积极推广使用节能环保材料利于环境保护,故B正确;
C.探索太阳能、氢能、地热能、海洋能和生物能等新型能源对解决能源危急有重要意义,故C正确;
D.化学反应伴随着物质和能量的变化,故D正确.
故选A.
点评 本题主要考查常见的生活环境的污染及治理、绿色化学的概念、化肥农药对人类生活的影响,难度不大,平时要注意多积累,做题时要积极联想,和所学知识联系起来.


科目:高中化学 来源: 题型:选择题
| A. | 30℃,块状锌与2 mol•L一1硫酸溶液反应 | |
| B. | 30℃,粉末状铁与2 mol•L一1硫酸溶液反应 | |
| C. | 60℃,粉末状锌与2 mol•L一1硫酸溶液反应 | |
| D. | 60℃,粉末状镁与2mol•L一1硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
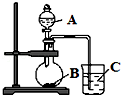 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
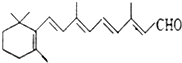 人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )| A. | 视黄醛的分子式为C20H27O | |
| B. | 视黄醛可以使溴水和酸性高锰酸钾溶液褪色,也能发生银镜反应 | |
| C. | 视黄醛分子结构中含有苯环、碳碳双键和醛基 | |
| D. | 1mol视黄醛在催化剂的作用下最多可与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
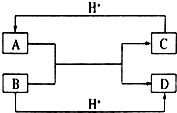 已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):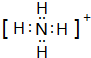 ;D
;D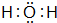 .写出B、C的离子符号或化学式:BOH-;CNH3.
.写出B、C的离子符号或化学式:BOH-;CNH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
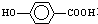 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.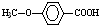 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
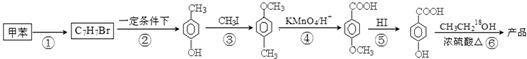
.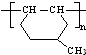 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com