
 ,
, .
.


科目:高中化学 来源: 题型:
| a | ||||
| b | ||||
| c | d | |||
| e |
| A、b元素除0价外,只有一种化合价 |
| B、五种元素中,c元素的性质最稳定 |
| C、b、d气态氢化物溶于水,溶液的酸性:b>d |
| D、e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
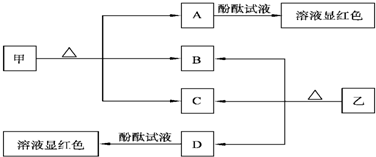
查看答案和解析>>
科目:高中化学 来源: 题型:
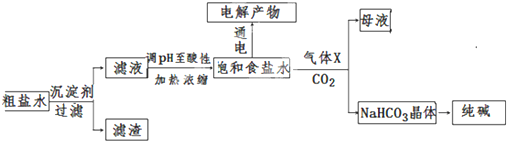
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
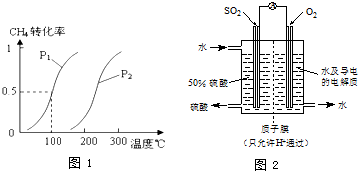
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
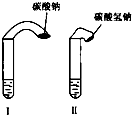 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com