
【题目】有下列物质的溶液:①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为____________(用序号表示,下同)。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为___________,经测定溶液中c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将_____(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)______,Ka______。
【答案】③>②=④>① 0.1mol/L 1.99×10-5 变大 变小 不变
【解析】
(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸;
(2)n(CH3COOH)=![]() =0.1mol,根据c=
=0.1mol,根据c=![]() 计算物质的量浓度;根据k=
计算物质的量浓度;根据k= 计算其大小并判断升温电离平衡常数的变化,结合外界条件对弱电解质的电离平衡的影响判断离子浓度的变化,电离平衡常数只受温度影响。
计算其大小并判断升温电离平衡常数的变化,结合外界条件对弱电解质的电离平衡的影响判断离子浓度的变化,电离平衡常数只受温度影响。
(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的物质的量浓度相同,c(H+)的大小顺序为:③>②=④>①;
(2)n(CH3COOH)=![]() =0.1mol,c(CH3COOH)=
=0.1mol,c(CH3COOH)=![]() =0.1mol/L;
=0.1mol/L;
c(CH3COO-)=c(H+)=1.4×10-3mol/L,k= =1.99×10-5;醋酸电离吸热,升温促进电离,电离平衡常数增大;向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,温度不变电离平衡醋酸不变。
=1.99×10-5;醋酸电离吸热,升温促进电离,电离平衡常数增大;向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,温度不变电离平衡醋酸不变。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJmol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol-1
A.H2(g)的燃烧热为571.6 kJmol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJmol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw不变
D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越______。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=_________(可用分数表示)。能说明该反应达到化学平衡状态的是_______(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是_________(选填序号)。
a.  b.
b.  c.
c. 
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a______b(填“>”“=”或“<”,下同),Q1_____92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
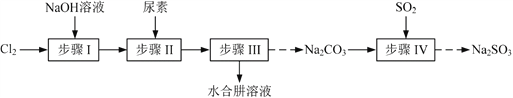
已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
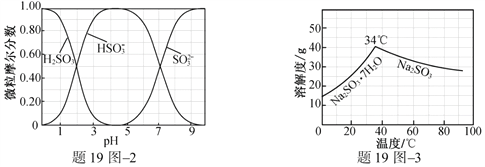
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。
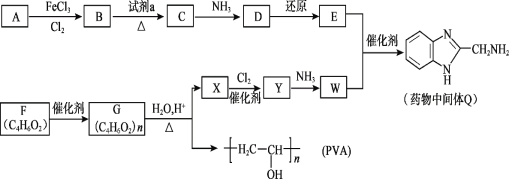
已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
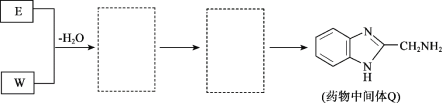
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的离子方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该反应的化学方程式___。配制FeCl3溶液和FeCl2溶液都应保持___(填“酸性”“碱性”或“中性”),原因是___。配制FeCl2溶液时还应加入少量铁屑,原因是___。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3- ②I3-+2S2O32-=3I-+S2O62-
反应①中的还原产物为___。现取10.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液12.50mL,此溶液中Cu2+的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③B.②④C.①③D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com