
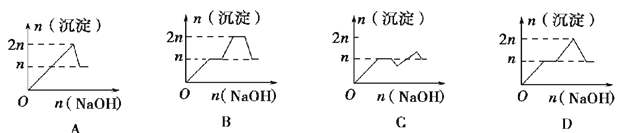
【题目】向含MgCl2、AlCl3均为n mol的混合液中逐滴加入NaOH溶液至过量,有关离子沉淀或沉淀溶解与pH关系如下表:
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3[来 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
列表示生成沉淀与加入NaOH的物质的量关系的图像中,关系正确的是
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子,是产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。人体缺E元素会得软骨病,D与E位于同主族。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C非金属性由强到弱的顺序为________。
(2)B的氢化物的分子式是________,B的氢化物溶于水的电离方程式为
________________________________________________________________________。
(3)写出化合物AC2的电子式:________,它是________(填“极性”或“非极性”)键形成的非极性分子。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
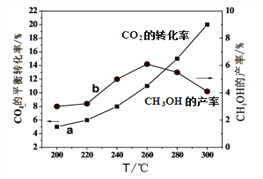
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.Fe3+、NH4+、SCN﹣、Cl﹣
B.Na+、H+、NO3﹣、SO42﹣
C.Fe2+、Fe3+、Na+、NO3﹣
D.Fe2+、NH4+、Cl﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的使用是人类拓展自身能力的标志之一。人类利用几种常用金属的先后顺序依次为金、铜、铁、铝,之所以有先后,主要取决于( )
A. 金属在地壳中的含量多少 B. 金属的熔沸点高低
C. 金属的活泼性强弱 D. 金属的导电性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com