
| A、Cl2使湿的红色布条褪色是因为HClO有漂白性 |
| B、合成纤维和光导纤维都是无机非金属材料 |
| C、纯碱、烧碱、漂白粉都属于盐类 |
| D、4.0g NaOH固体中所含分子数为0.1NA(NA表示阿伏加德罗常数的值) |


科目:高中化学 来源: 题型:
| A、加入AgNO3溶液和稀HNO3,看是否有浑浊出现 |
| B、加入BaCl2溶液和稀HCl,看是否有浑浊出现 |
| C、先加过量的BaCl2溶液和稀HNO3,取上层清液再加AgNO3溶液,看是否有浑浊出现 |
| D、先加过量的Ba(NO3)2溶液和稀HNO3,取上层清液再加AgNO3溶液,看是否有浑浊出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | P-P | P-O | OO | PO |
| 键能(kJ?mol-1) | 198 | 360 | 498 | X |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 微生物 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、26g乙炔所含共用电子对数目为2NA |
| C、标准状况下,11.2L CCl4所含分子数为0.5NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
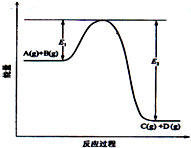 反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:
反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com