
硼及其化合物在催化剂制造、储氢材料、燃料电池等方面应用广泛。Li3BN2是一种价格低廉且性能优良的储氢材料,其储氢与放氢原理为Li3BN2+4H2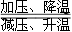 Li3BN2H8。下列有关说法正确的是
Li3BN2H8。下列有关说法正确的是
| A.B的原子半径小于N的原子半径 |
| B.H2的结构式为H—H |
| C.放氢过程为化合反应 |
| D.储氢过程没有能量变化 |
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.NH4Cl为共价化合物 |
| B.N2分子中含有一对共用电子对 |
| C.Na2O2既含有离子键又含有非极性键 |
| D.电解水与电解熔融NaCl时破坏的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
| A.③④⑦⑧ | B.①③④⑦⑧ | C.①②⑤⑥⑨ | D.①④⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯化钠是日常生活中人们常用的调味品,下列性质可以证明氯化钠中一定存在离子键的是
| A.具有较高的熔点 | B.熔融状态下能导电 |
| C.水溶液能导电 | D.常温下能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NH3、H2O等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实可推ABn型分子是非极性分子的经验规律是( )
| A.在ABn分子中A原子的所有价电子都参与成键 |
| B.在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C.在ABn分子中每个共价键的键长都相等 |
| D.分子中不能含有氢原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com