

| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的Ph | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
分析 从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO${\;}_{4}^{2-}$)中加入Al2O3,调节溶液的pH值,得到滤渣A为氢氧化铝和氢氧化铬,滤液中主要是硫酸镁溶液,滤渣A中加入过量的氢氧化钠得CrO2-、AlO2-溶液,加入氧气将CrO2-氧化为CrO42-,再加入硫磺,过滤得氢氧化铬沉淀和S2O32-、AlO2-溶液,在S2O32-、AlO2-溶液中通入二氧化碳,过滤得滤渣B为Al(OH)3,氢氧化铝受热分解得Al2O3,电解Al2O3得铝,氢氧化铬沉淀在空气中充分加热得Cr2O3,Cr2O3和Al发生铝热反应得铬,根据装置图可知,用铬制取铬酸钠(Na2CrO4),铬作阳极,铬发生氧化反应,在碱性溶液中生成CrO42-,电解池中阴、阳极流过的电量相等,据此答题.
解答 解:从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO${\;}_{4}^{2-}$)中加入Al2O3,调节溶液的pH值,得到滤渣A为氢氧化铝和氢氧化铬,滤液中主要是硫酸镁溶液,滤渣A中加入过量的氢氧化钠得CrO2-、AlO2-溶液,加入氧气将CrO2-氧化为CrO42-,再加入硫磺,过滤得氢氧化铬沉淀和S2O32-、AlO2-溶液,在S2O32-、AlO2-溶液中通入二氧化碳,过滤得滤渣B为Al(OH)3,氢氧化铝受热分解得Al2O3,电解Al2O3得铝,氢氧化铬沉淀在空气中充分加热得Cr2O3,Cr2O3和Al发生铝热反应得铬,根据装置图可知,用铬制取铬酸钠(Na2CrO4),铬作阳极,铬发生氧化反应,在碱性溶液中生成CrO42-,电解池中阴、阳极流过的电量相等,
(1)根据上面的分析可知,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH,得到氢氧化铝和氢氧化铬,
故答案为:调节溶液的pH;
(2)步骤①的实验目的是得到氢氧化铝和氢氧化铬,根据表中的数据可知,废液的pH应保持在(5.3,7.8)范围,
故答案为:(5.3,7.8);
(3)步骤②中生成NaCrO2的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(4)步骤④中硫与CrO42-发生氧化还原反应,生成硫代硫酸根离子和氢氧化铬,反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-,
故答案为:7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-;
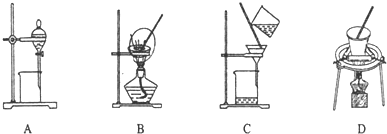
(5)根据上面的分析可知,步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,固体加热可在坩埚中加热,故可选用的装置是D,
故答案为:使Cr(OH)3完全转化为Cr2O3;D;
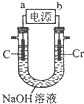
(6)①根据装置图可知,用铬制取铬酸钠(Na2CrO4),铬作阳极,铬发生氧化反应,在碱性溶液中生成CrO42-,所以a是电源的负极,阳极的电极反应式为Cr-6e-+8 OH-=CrO42-+4H2O,
故答案为:负;Cr-6e-+8 OH-=CrO42-+4H2O;
②阴极的电极反应式为2H2O+2e-=2OH-+H2↑,根据电极反应式可知,若电解一段时间后阴极收集到标准状况下的气体3.36L即0.15mol,则转移电子的物质的量为0.3mol,再根据电极反应式Cr-6e-+8 OH-=CrO42-+4H2O 可知,理论上可制得铬酸钠的物质的量为0.05mol,所以铬酸钠的质量为0.05mol×162g/mol=8.1g,
故答案为:8.1.
点评 本题属于工艺流程制备题目,考查制备原理、实验方案评价、物质分离提纯、获取信息的能力,是对基础知识的综合考查,难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:多选题
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 molCl2,各转移2mole- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1molS,各转移6mole- | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解 加适量BaCl2溶液 过滤 | |
| B. | 溶解 加适量CaCl2溶液 过滤 | |
| C. | 溶解 加适量Ca(OH)2溶液 过滤 | |
| D. | 溶解 加适量盐酸 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | N2 | Cl2 | Br2 | I2 | O2 |
| 键能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 键长(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物时,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 反应:Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,液面超过滤纸的边缘 | |
| B. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| C. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com