
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.升高温度,化学反应速率加快 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
A.已知K=
| ||
| B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大 | ||
| C.常温下,向纯水中加入碳酸钠固体,水的电离程度变大,Kw变大 | ||
| D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.②③④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol?L-1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol?L-1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
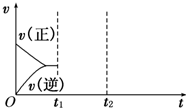
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D | |
| H2 | 6 | 1 | 3.5 | 5 |
| N2 | 2 | 0 | 1 | 1.5 |
| NH3 | 0 | 4 | 2 | 1 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正、逆反应速率都增大,平衡向正反应方向移动 |
| D.正、逆反应速率都增大,平衡不发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com