
| A. | 减小C或D的浓度 | B. | 减小B的浓度 | C. | 增大A或B的浓度 | D. | 减小A的浓度 |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O3含有的氧原子数为NA | |
| B. | 常温常压下,22.4L SO2含有的分子数为NA | |
| C. | 1molMg变成Mg2+时,失去电子的数目为NA | |
| D. | 1L 1mol•L-1H2SO4溶液中含H+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 | 现象 |
| (1)其中e气体是有色的,其余气体均为无色,a、f是两种常见的大气污染物 | |
| (2)a和b在常温下混合 | 气体变红棕色 |
| (3)c和d混合 | 能产生白烟 |
| (4)b、e、f分别通入氢硫酸中 | 都产生淡黄色浑浊 |
| A. | NO、O2、NH3、HCl、Cl2、SO2 | B. | NO、O2、NH3、HCl、SO2、Cl2 | ||
| C. | NO、O2、NH3、CO2、NO2、SO2 | D. | O2、NH3、NO、HCl、Cl2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
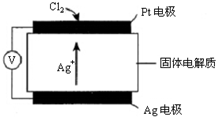 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,要将水沿器壁慢慢倒入浓硫酸中,并不断搅拌 | |
| B. | 实验需要0.1 mol•L-1的Na2CO3溶液480 mL,配制时需用500 mL容量瓶 | |
| C. | 在测量温度时,温度计水银球紧贴容器内壁不影响测量结果 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
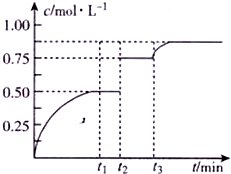 一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的m=2 | |
| B. | t2时刻改变的条件是加人了催化剂或加压 | |
| C. | t3时刻改变的条件是移去少里物质W | |
| D. | t3时刻改变的条件可能是增加了X的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com