
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中有CaF2产生沉淀 |
分析 A.HF酸为弱酸,溶液中不能完全电离;
B.Ksp只与温度有关;
C.根据浓度商Qc与Ksp的大小店铺;
D.根据该体系中的浓度商与溶度积的大小进行判断.
解答 解:A.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3ol/L,则Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,说明有沉淀产生,故C错误;
D.根据C的计算可知,该体系中有沉淀生成,故D正确;
故选D.
点评 本题考查难溶物溶解平衡及溶度积的计算,题目难度中等,注意利用溶度积判断沉淀能否生成,把握影响平衡常数的因素即可解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
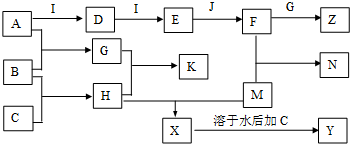
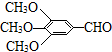 )和抗癫痫药物H(
)和抗癫痫药物H(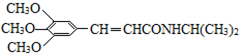 )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):
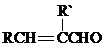 +H2O
+H2O +2Br2→
+2Br2→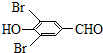 +2HBr;
+2HBr;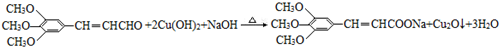 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜片消耗完所需时间 | |
| B. | 反应中氧化剂得到电子总数 | |
| C. | 反应后溶液中铜离子浓度(反应后溶液体积不变) | |
| D. | 反应生成气体的体积(同温、同压) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 气态氢化物的还原性:X>Y、M>R | B. | 原子半径:Z>M>R、M<X<Y | ||
| C. | M与Z的原子核外电子数相差16 | D. | Q的最高价氧化物一定能溶于强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com