
【题目】CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
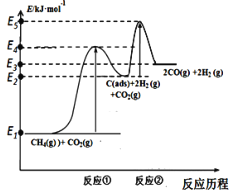
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+![]() 。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
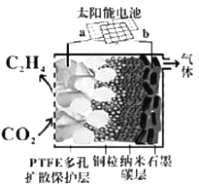
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。
【答案】CH4 (g) + CO2 (g)2CO (g) + 2H2 (g) ΔH= +(E3 - E1) kJ·mol-1 该反应正向吸热,气体计量数增大(熵增),高温有利于正向自发进行 < < > C 正 2CO2 + 12e- + 8H2O = C2H4 + 12OH-
【解析】
Ⅰ.(1)焓变△H=生成物的总内能反应物的总内能,结合物质的凝聚状态写出热化学方程式;根据化学反应自发进行的条件判断;反应越慢,反应的活化能越高,据此解答;
II.由lnKc=-2.205+![]() 可知,温度T越大,则Kc越小,即升高温度,Kc减小,所以2CH3OH(g)CH3OCH3(g)+H2O(g)的△H<0;
可知,温度T越大,则Kc越小,即升高温度,Kc减小,所以2CH3OH(g)CH3OCH3(g)+H2O(g)的△H<0;
(2)升高温度,平衡逆向进行,即v正<v逆,结合速率常数k的变化分析;
(3)根据浓度熵Qc与平衡常数K的关系若Qc>K,则反应逆向进行;
(4)根据lnKc=-2.205+![]() 和T=500K计算平衡常数Kc,结合反应三段式计算平衡时CH3OCH3(g)的物质的量和物质的量分数;
和T=500K计算平衡常数Kc,结合反应三段式计算平衡时CH3OCH3(g)的物质的量和物质的量分数;
Ⅲ.(5)由电解装置图可知,a电极上CO2发生得电子的还原反应生成C2H4,所以a电极为阴极、b为阳极,阴极上CO2得电子生成C2H4,结合电子守恒和电荷守恒写出电极反应式。
Ⅰ.(1)CH4与CO2制备“合成气”的化学方程式为CH4(g)+CO2(g)2H2(g)+2CO(g),由图可知故反应的焓变△H=生成物的总内能反应物的总内能=(E3E1)kJ/mol,反应的热化学方程式为CH4(g)+CO2(g) 2CO(g)+2H2 (g) △H=+(E3E1)kJ/mol;该反应正向吸热,气体计量数增大(熵增),高温有利于正向自发进行;两步历程中反应①是慢反应,所以反应①的活化能大于反应②的活化能,即E4E1>E5E2,所以E5+E1<E4+E2;
II.由lnKc=-2.205+![]() 可知,温度T越大,则Kc越小,即升高温度,Kc减小,所以2CH3OH(g)CH3OCH3(g)+H2O(g)的△H<0;
可知,温度T越大,则Kc越小,即升高温度,Kc减小,所以2CH3OH(g)CH3OCH3(g)+H2O(g)的△H<0;
(2)升高温度,正逆反应速率均增大,但平衡逆向进行,v正<v逆,所以k正增大的倍数小于k逆增大的倍数;
(3)2CH3OH(g)CH3OCH3(g)+H2O(g)是气体体积不变化的反应,可用物质的量代替浓度代入表达式中计算,浓度熵Qc=![]() =
=![]() =1<200=Kc,所以反应正向进行,v正>v逆;
=1<200=Kc,所以反应正向进行,v正>v逆;
(4)T=500K时,lnKc=-2.205+![]() =2.205+
=2.205+![]() =3.2122274,Kc=e3.2122274,所以22<e3.2122274<34,即4<Kc<81,设CH3OH的起始量为2mol,CH3OCH3生成的物质的量为xmol,则反应的三段式为:
=3.2122274,Kc=e3.2122274,所以22<e3.2122274<34,即4<Kc<81,设CH3OH的起始量为2mol,CH3OCH3生成的物质的量为xmol,则反应的三段式为:
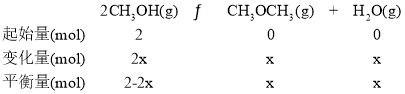
平衡常数Kc=![]() =
=![]() =
=![]() ×
×![]() ,
,![]() =4Kc,16<
=4Kc,16<![]() =4Kc<324,解得
=4Kc<324,解得![]() <x<
<x<![]() ,体系中CH3OCH3(g)的物质的量分数为
,体系中CH3OCH3(g)的物质的量分数为![]() ×100%,在40%~47.4%之间;
×100%,在40%~47.4%之间;
(5)①由电解装置图可知,a电极上CO2发生得电子的还原反应生成C2H4,所以a电极为阴极、b为阳极,阳极与电源正极相接、阴极与电源负极相接;
②阴极上CO2得电子生成C2H4,电极反应式为2CO2 + 12e- + 8H2O = C2H4 + 12OH-。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】无色透明的锆石(主要成分为ZrSiO4)酷似钻石,是很好的钻石代用品。锆石又称锆英石,常含有铁、铝、铜的氧化物杂质。工业上一种以锆英石为原料制备ZrO2的工艺流程如图所示:
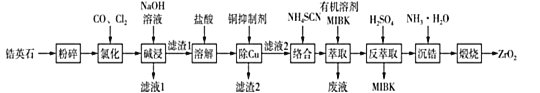
己知:i.Zr在化合物中通常显+4价,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物;
ii.SiC14极易水解生成硅酸;ZrC14易溶于水,390℃升华;
iii.Fe(SCN)3难溶于有机溶剂MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度。
请回答下列问题:
(1)“粉碎”锆英石的目的为 ___。
(2)①“氯化”过程中,锆英石发生的主要反应的化学方程式为 ___。
②“氯化”过程中ZrC14的产率与温度、压强的关系如图所示:

由图可知,“氯化”过程选择的最佳条件为____,“氯化”温度超过390℃时,ZrC14产率降低的原因为 ___。
(3)“滤液1”中含有的阴离子除OH-、Cl-外,还有 _______。
(4)①常用的铜抑制剂有NaCN(氰化钠),NaCN可与铜离子反应生成Cu(CN)2{Ksp[Cu(CN)2]=4×10-10}沉淀。己知盐酸溶解后的溶液中Cu2+的浓度为1 molL-1,当溶液中Cu2+浓度不大于1×10-6 molL-1时即达到后续生产的要求,则欲处理1L该溶液至少需要2molL-1的NaCN溶液的体积为____L(溶液混合时的体积变化忽略不计,计算结果保留两位小数)。
②由于氰化钠有剧毒,所以需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将氰化钠氧化,其中一种产物为空气的主要成分。请写出在碱性条件下漂白液与氰化钠反应的离子方程式____。
(5)通过“萃取”“反萃取”可以分离铁,富集锆,原理为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连物化所CO2催化转化为CO的研究获得新成果。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化。下列说法不合理的是( )
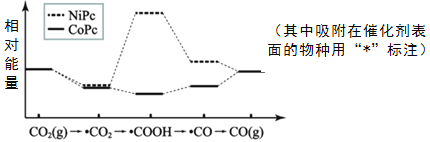
A.转化过程中有极性键形成
B.*CO2经氧化反应得到*COOH
C.吸附在NiPc和CoPc表面带有相同基团的物种其能量不同
D.该研究成果有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
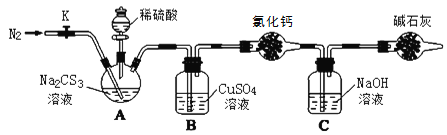
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。
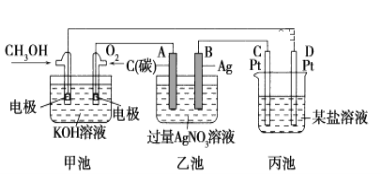
(1)图中甲池是________装置(填“电解池”或“原电池”)
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的电极反应式:______________。
(4)若丙中电极不变,将其溶液换成NaCl溶液,丙池中总反应的离子方程式:__________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明[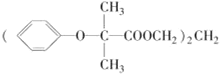 ]可用于降低血液中的胆固醇,该物质合成线路如图所示:
]可用于降低血液中的胆固醇,该物质合成线路如图所示:
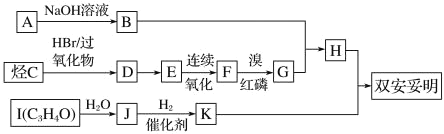
已知:Ⅰ.RCH2COOH![]()
![]()
![]()
![]() 。
。
Ⅱ.RCH=CH2![]() RCH2CH2Br。
RCH2CH2Br。
Ⅲ.C 的密度是同温同压下 H2 密度的 28 倍,且支链有一个甲基,I能发生银镜反应且 1 molI(C3H4O)能与 2 mol H2 发生加成反应;K 的结构具有对称性。试回答:
(1)A的结构简式为__________。
(2)反应 D→E 的化学方程式为________; 反应类型是_______。
(3)C 的名称为______。
(4)与 F 互为同分异构体,且属于酯的有机物有_____种。其中核磁共振氢谱有 3 组峰,峰面积之比为 6∶1∶1 的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
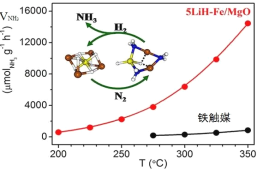
A.转化过程中有非极性键断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com