
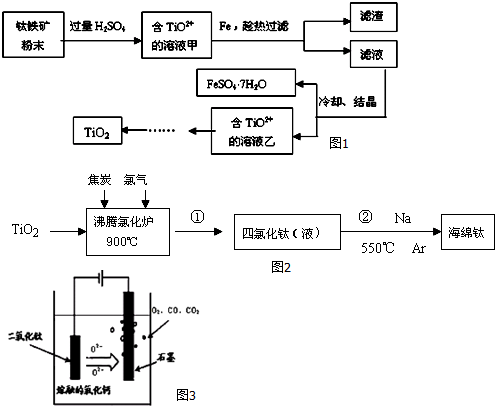
分析 I.钛铁矿用硫酸溶解,得到溶液中含有TiO2+、Fe2+、Fe3+,加入Fe粉将Fe3+还原为Fe2+,过滤除去不溶物,滤液冷却结晶析出硫酸亚铁晶体,过滤分离,滤液中经过系列转化得到TiO2;
(1)Fe2O3与H2SO4反应生成硫酸铁与水;
(2)加入Fe粉将Fe3+还原为Fe2+;
Ⅱ.(3)在550℃时、氩气环境下,Na与四氯化钛发生置换反应;高温时,Na、Ti易与空气中的氧气等发生反应;
Ⅲ.TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子;根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答.
解答 解:I.钛铁矿用硫酸溶解,得到溶液中含有TiO2+、Fe2+、Fe3+,加入Fe粉将Fe3+还原为Fe2+,过滤除去不溶物,滤液冷却结晶析出硫酸亚铁晶体,过滤分离,滤液中经过系列转化得到TiO2;
(1)Fe2O3与H2SO4反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)加Fe的作用是:将Fe3+还原为Fe2+,故答案为:将Fe3+还原为Fe2+;
Ⅱ.(3)在550℃时、氩气环境下,Na与四氯化钛发生置换反应,反应方程式为:TiCl4+4Na$\frac{\underline{\;550℃\;}}{氩气}$4NaCl+Ti,高温时,Na、Ti易与空气中的氧气等发生反应,所以该反应需要在Ar气氛中进行,
故答案为:TiCl4+4Na$\frac{\underline{\;550℃\;}}{氩气}$4NaCl+Ti;防止高温下Na(Ti)与空气中的O2(或N2、CO2)作用;
Ⅲ.(4)TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子,阴极电极反应式为:TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-;
III.(4)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连,电极反应式为TiO2+4e-=Ti+2O2-;
故答案为:TiO2+4e-=Ti+2O2-;
(5)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题以金属的冶炼为载体,考查化学工艺流程、电解原理、离子浓度大小比较、信息获取等问题,有利于培养学生分析解决问题能力、信息获取与知识移运用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
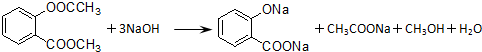 .
.
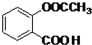 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
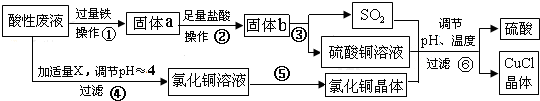
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com