
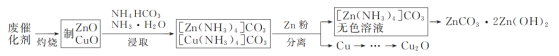
【题目】实验室以合成氨(低温变换的)废催化剂(主要含Zn、Cu的单质和氧化物)为原料制取ZnCO3·2Zn(OH)2和Cu2O,其实验流程如图:
(1)“灼烧”时,需用的硅酸盐质仪器除玻璃棒、酒精灯外,还有___和___。
(2)“浸取”时,生成[Zn(NH3)4]CO3的离子方程式为___。
(3)加“Zn粉”时,为使Zn粉不过量太多{已知:溶液中[Cu(NH3)4]2+呈深蓝色},合适的操作方法及依据的现象是___;分离出的铜粉中混有少量Zn,提纯铜粉的方案是__。
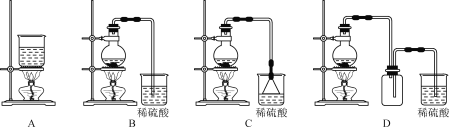
(4)已知反应:[Zn(NH3)4]2+![]() Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
(5)设计以提纯后的铜粉为原料制取Cu2O的实验方案:向烧杯中加入计量的铜粉,__,静置、冷却、过滤、水洗及干燥[已知在约50℃时,发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O。实验中必须使用的试剂:稀硫酸、葡萄糖溶液、10%的NaOH溶液和15%的H2O2溶液]。
【答案】坩埚 泥三角 ZnO+3NH3·H2O+NH![]() +HCO
+HCO![]() =[Zn(NH3)4]2++CO
=[Zn(NH3)4]2++CO![]() +4H2O 搅拌下分次加入Zn粉,直到最后加入Zn粉时,溶液颜色由深蓝色变为无色 用稀硫酸溶解、过滤和水洗(干燥) CD 搅拌下加入稍过量硫酸和过量的15%的H2O2溶液,加热至约50℃,待铜粉完全溶解时,煮沸溶液片刻(除去过量H2O2),冷却至室温,向溶液中加入10%的NaOH溶液至沉淀完全,再加入一定量的10%的NaOH溶液和足量葡萄糖溶液,充分加热
+4H2O 搅拌下分次加入Zn粉,直到最后加入Zn粉时,溶液颜色由深蓝色变为无色 用稀硫酸溶解、过滤和水洗(干燥) CD 搅拌下加入稍过量硫酸和过量的15%的H2O2溶液,加热至约50℃,待铜粉完全溶解时,煮沸溶液片刻(除去过量H2O2),冷却至室温,向溶液中加入10%的NaOH溶液至沉淀完全,再加入一定量的10%的NaOH溶液和足量葡萄糖溶液,充分加热
【解析】
实验室以合成氨(低温变换的)废催化剂(主要含Zn、Cu的单质和氧化物)为原料燃烧制得氧化锌、氧化铜;在碳酸氢铵、氨水混合液中浸取得到[Zn(NH3)4]CO3、[Cu(NH3)4] CO3,加入锌粉反应后分离得到无色溶液[Zn(NH3)4]CO3和铜,铜进一步制得Cu2O;[Zn(NH3)4]CO3进一步制取得到ZnCO3·2Zn(OH)2,所此分析。
(1)灼烧需要用到的硅酸盐质仪器有玻璃棒、泥三角、坩埚和酒精灯,故答案为坩埚、泥三角;
(2)“浸取”时,生成[Zn(NH3)4]CO3,反应物为NH3、ZnO、NH4HCO3,根据元素守恒可得反应的离子方程式为ZnO+3NH3·H2O+NH![]() +HCO
+HCO![]() =[Zn(NH3)4]2++CO
=[Zn(NH3)4]2++CO![]() +4H2O;
+4H2O;
(3)加“Zn粉”时,已知:溶液中[Cu(NH3)4]2+呈深蓝色,为使Zn粉不过量太多,在搅拌下分次加入Zn粉,直到最后加入Zn粉时,溶液颜色由深蓝色变为无色;用稀硫酸溶解、过滤和水洗(干燥),分离出的铜粉中混有少量Zn,从而提纯铜粉;
(4)已知反应:[Zn(NH3)4]2+![]() Zn2++4NH3,K=3.5×10-10,反应为熵增、焓增的反应,高温有利于平衡正向移动,生成的氨气密度小于空气且极易溶于水,故由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置可加热溶液且吸收生成的氨气防倒吸等,故答案选CD;
Zn2++4NH3,K=3.5×10-10,反应为熵增、焓增的反应,高温有利于平衡正向移动,生成的氨气密度小于空气且极易溶于水,故由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置可加热溶液且吸收生成的氨气防倒吸等,故答案选CD;
(5)设计以提纯后的铜粉为原料制取Cu2O的实验方案:向烧杯中加入计量的铜粉,搅拌下加入稍过量硫酸和过量的15%的H2O2溶液,加热至约50℃,待铜粉完全溶解时,煮沸溶液片刻(除去过量H2O2),冷却至室温,向溶液中加入10%的NaOH溶液至沉淀完全,再加入一定量的10%的NaOH溶液和足量葡萄糖溶液,充分加热,静置、冷却、过滤、水洗及干燥。


科目:高中化学 来源: 题型:
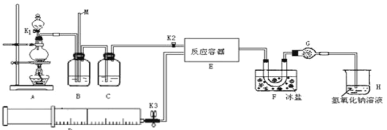
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
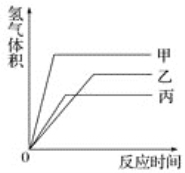
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关问题:
(1)用0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出__________kJ的能量。
(2)如图所示装置中,仪器A的名称是_______________,作用是___________________________;碎泡沫塑料的作用是__________________________________。
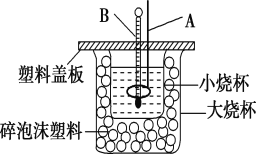
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、 C、 D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水。

四种盐在不同温度下的溶解度(g/100 g水)表(说明:①>35 ℃ NH4HCO3会有分解)

请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是___________________。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是_________________。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去____(杂质以化学式表示)。
(5)将锥形瓶中的产物过滤后,所得的母液中含有___________(以化学式表示),加入氯化氢,并进行_________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗菌化合物X可由埃及地中海沿岸采集的沉积物样品中分离得到,其结构简式如图所示。下列有关化合物X的说法正确的是( )
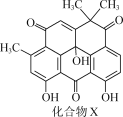
A.分子中有两个手性碳原子
B.分子中所有碳原子位于同一平面
C.能与酸性KMnO4溶液反应
D.1mol化合物X至多与1molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A. 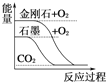 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应
B. 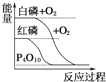 白磷比红磷稳定
白磷比红磷稳定
C. 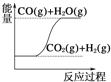 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
D. 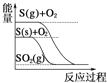 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe3H2O}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3 反应制得:2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe3H2O+CO2↑。
Ⅰ.制备FeCO3:装置如图所示。
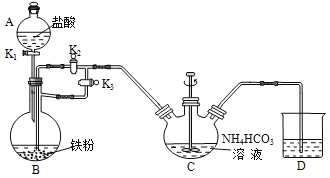
(1)B的名称是____。
(2)①清洗仪器,检查装置气密性的方法是:在D处导管末端套上夹止水夹的橡胶管,在A中加入水,分别打开活塞K1和K3。关闭活塞K2,若观察到___,则气密性良好。
②倒掉A中的水,加入盐酸,在B中加入铁粉、C中加入NH4HCO3溶液。关闭活塞K2,打开活塞K1和K3;滴入足量盐酸后,关闭活塞K1,开动搅拌器,反应一段时间后关闭活塞K3,打开活塞K2,C中发生的反应的离子方程式为____。
Ⅱ.制备乳酸亚铁晶体:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是___。从所得溶液中获得乳酸亚铁晶体所需的实验操作是:隔绝空气低温蒸发,冷却结晶,____、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com