
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、将pH相同的盐酸和醋酸稀释相同倍数,醋酸的pH变化大 |
| C、10 mL0.10 mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH都相同HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、实验室制Fe(OH)2时应将汲有NaOH溶液的胶头滴管伸入FeSO4溶液液面下,缓缓挤出碱液 |
| B、镁铝合金的硬度和熔点都比纯铝和纯镁大 |
| C、结晶形和无定形二氧化硅统称硅石 |
| D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而常温耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B、Mg(OH)2的溶度积小于MgCO3的溶度积,且在水中发生了沉淀转化 |
| C、MgCO3电离出的CO32-发生水解,使水中OH-浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀 |
| D、MgCO3电离出的CO32-发生水解,使水中OH-浓度增大,对Mg (OH)2的沉淀溶解平衡而言,Qc>Ksp生成Mg(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,对于反应mA(g)+nB(g)?cC(g)+aD(g),C物质的质量分数[w(C)]与温度,压强的关系如图所示,下列判断正确的是( )
在一定条件下,对于反应mA(g)+nB(g)?cC(g)+aD(g),C物质的质量分数[w(C)]与温度,压强的关系如图所示,下列判断正确的是( )| A、△H>0,m+n>c+d |
| B、△H<0,m+n<c+d |
| C、△H>0,m+n<c+d |
| D、△H<0,m+n>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.则2E1>E2 |
| C、l0lkPa 时,2H2(g)+O2(g)=2H2O(1);△H=-571.6kJ?mol-1,H2的燃烧热为571.6kJ/mol |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,含 1molNaOH 的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
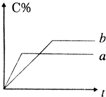 可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )
可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| C、其他条件相同,若只改变温度,则a比b的温度高且Q>0 |
| D、其他条件相同,a表示减少A的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com