
| A. | X3Y2 | B. | X2Y | C. | XY2 | D. | XY3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H+?H2CO3 | B. | HCO3-+OH-═H2O+CO32- | ||
| C. | NH3+H+═NH4+ | D. | NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
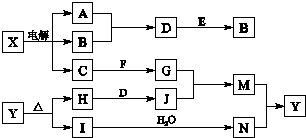
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ①③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①④③②⑥⑤ | D. | ①③④②⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com