
 ,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4;
,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4; ;Si3N4;
;Si3N4;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
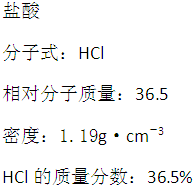 如图为实验室某浓盐酸试剂瓶的标签上的盐酸分子式:HCl相对分子质量:36.5密度:1.19g?cm-3HCl的质量分数:36.5%有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的盐酸分子式:HCl相对分子质量:36.5密度:1.19g?cm-3HCl的质量分数:36.5%有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烃基与羧基直接相连的化合物叫做羧酸 |
| B、饱和链状羧酸的组成符合CnH2nO2 |
| C、羧酸在常温下都能发生酯化反应 |
| D、羧酸的官能团是-COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com