

| V��10-3L |
| 22.4L/mol |
| ||
| ag |
| 39V |
| 56a |
| 39V |
| 56a |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Һ�У�c��CO32-����c��H2CO3�� |
| B����Һ��pH���ڣ��� |
| C����Һ�е����������ࣺ�ڣ��� |
| D������Һ�У�c��HCO3-����c��H2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
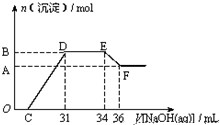 ijͬѧȡһ����Fe��Al�Ļ������һ������ϡ�������ַ�Ӧ����֪����Ļ�ԭ�������һ�֣��ڷ�Ӧ���������Һ�У���μ���4mol?L-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Է������ᱻ��ԭ�����ɵIJ���Ϊ��������
ijͬѧȡһ����Fe��Al�Ļ������һ������ϡ�������ַ�Ӧ����֪����Ļ�ԭ�������һ�֣��ڷ�Ӧ���������Һ�У���μ���4mol?L-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Է������ᱻ��ԭ�����ɵIJ���Ϊ��������| A��NH4NO3 |
| B��NO2 |
| C��NO |
| D��N2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�11.2 L��������ԭ����ĿΪNA |
| B��2 L 0.2 mol/L��K2SO4��Һ��K+��ĿΪ0.8NA |
| C��1 mol Fe����ԭ�����ṩ������Ϊ2NA |
| D����״���£�NA��CO2���Ӻ�NA��H2O���ӵ������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | ����ѪҺ�����/mL | ����KMnO4��Һ�����/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n(H2O) |
| n(CH4) |
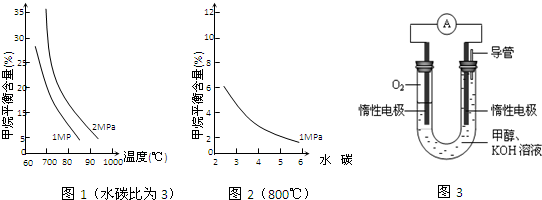
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� �� ��  ����ͬ�������� ����ͬ�������� |
| B��CH3COOH��Ӳ֬�ᣨC17H35COOH������ͬϵ�� |
C�� �� ��  ����ͬһ������ ����ͬһ������ |
D�� �� �� ����ͬ���칹�� ����ͬ���칹�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com