
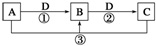
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).分析 (1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2;工业上制取A是利用电解饱和食盐水的方法得到;
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,D为氧气;
(3)若D是氯碱工业的主要产品,B有两性,则B为Al(OH)3,由转化关系可知,D为NaOH,C为NaAlO2;
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,应为SO2,则A为H2S,D为O2,B为S.某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,是因为亚硫酸被空气中的氧气氧化为硫酸,酸性增强;
解答 解:(1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2,工业上制取A的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑
故答案为:FeCl3;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,D为氧气,反应①的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)若D是氯碱工业的主要产品,B有两性,则B为Al(OH)3,由转化关系可知,D为NaOH,C为NaAlO2,则反应②的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,应为SO2,则A为H2S,D为O2,B为S,则反应③的化学方程式为:2H2S+SO2═3S↓+2H2O,酸雨的pH呈减小趋势,是因为亚硫酸被空气中的氧气氧化为硫酸,酸性增强,反应的离子方程式为:2H2SO3+O2═4H++2SO42-,
故答案为:2H2S+SO2═3S↓+2H2O,2H2SO3+O2═4H++2SO42-;
点评 本题考查无机物推断,属于开放性题目,正确推断物质是解本题关键,注意某些物质的特殊性质,需要学生熟练掌握元素化合物性质,题目难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物:是否含有共价键 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气发生取代反应 | |
| B. | 丙烯与水在催化剂的作用下发生加成反应 | |
| C. | 异戊二烯[CH2═C(CH3)-CH═CH2]与等物质的量的Br2发生加成反应 | |
| D. | 2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝和干冰升华 | B. | 钠和硫熔化 | ||
| C. | 食盐和氯化氢溶解于水 | D. | 二氧化硅和二氧化硫熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 9:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 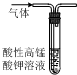 除去CO2中混有的SO2 | B. | 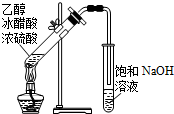 制取较纯净的乙酸乙酯 | ||
| C. | 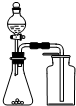 用生石灰和浓氨水制取氨气 | D. |  分离苯和四氯化碳的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com