
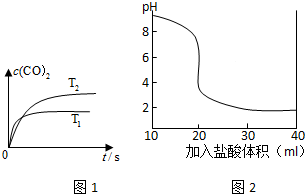
| ||
| 0.02×0.10-0.10V×10 -3 |
| 0.2+10 -3V |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| B、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、在轮船水线以下的船体装上一定数量的锌块可以保护轮船 |
| D、锅炉中沉积的CaSO4可直接用稀盐酸溶解除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 试样 | NaCl溶液(Na2CO3) | NaCl固体(I2) | CO2(SO2) | NaHCO3溶液(Na2CO3) |
| 除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
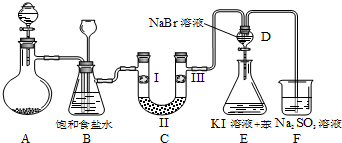
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物一定是金属氧化物 |
| B、氧化剂在化学反应中一定被氧化 |
| C、某原子的质量数也就是它的相对原子质量 |
| D、摩尔质量相同的物质其摩尔体积一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al 是地壳中含量最多的元素 |
| B、Al 是比较活泼的金属,在化学反应中容易失去电子,表现氧化性 |
| C、Al箔在空气中受热可以熔化,且发生剧烈燃烧 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com