
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤
如下:
① 高温下用碳还原二氧化硅制得粗硅 300℃
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si +3HCl =====SiHCl3+H2
③SiHCl3 与过量 H2 在 1000~1100℃反应制得纯硅
已知 SiHCl3,能与 H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 __________________。
(2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点
57.6℃)和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为。
(3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去):
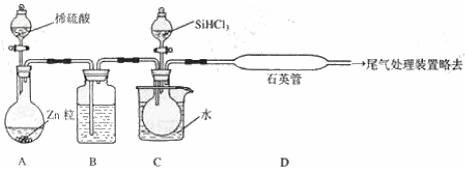
①装置 B中的试剂是 ______________。
装置 C中的烧瓶需要加热,其目的是 _____________________。
②反应一段时间后,装置 D中观察到的现象是 _________________,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以
及____________________ 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________ 。
a. 碘水 b.氯水 c.NaOH溶液
b. d.KSCN溶液 e.Na2SO3 溶液
科目:高中化学 来源: 题型:阅读理解
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.| A-B | A=B | A≡B | ||
| CO | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ?mol-1) | 441.2 273 | |||
| N2 | 键能(kJ?mol-1) | 154.8 | 418.3 | 941.7 |
| 键能差值(kJ?mol-1) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三上学期第二次月考化学试卷 题型:选择题
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系:
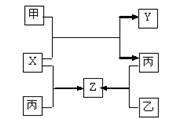
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
A.X是具有极性键的非极性分子 B.Z是水煤气的主要成分之一
C.甲和X的反应是吸热反应 D.丙是生产硅的重要原料
查看答案和解析>>
科目:高中化学 来源:2011年福建省福州三中高考化学练习试卷(解析版) 题型:解答题
| A-B | A=B | A≡B | ||
| CO | 键能 | 357.7 | 798.9 | 1071.9 |
| 键能差值 | 441.2 273 | |||
| N2 | 键能 | 154.8 | 418.3 | 941.7 |
| 键能差值 | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系:
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
A.X是具有极性键的非极性分子 B.Z是水煤气的主要成分之一
C.甲和X的反应是吸热反应 D.丙是生产硅的重要原料
查看答案和解析>>
科目:高中化学 来源:2012届河北省三河一中高三上学期第二次月考化学试卷 题型:单选题
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系: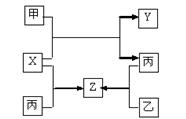
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
| A.X是具有极性键的非极性分子 | B.Z是水煤气的主要成分之一 |
| C.甲和X的反应是吸热反应 | D.丙是生产硅的重要原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com