
 有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:分析 该溶液为无色透明溶液,则溶液中不含Fe3+、Cu2+,向溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则溶液中存在Cl-;向溶液中加入氢氧化钠溶液,根据图象知,先随着加入氢氧化钠量的增多,沉淀的量增大,当达到一定程度后,再加入氢氧化钠,沉淀的量减少,但最终还有白色沉淀,说明溶液还含有Al3+、Mg2+,则溶液中不含CO32-、OH-;
(1)根据以上分析判断;
(2)根据OH-+Al(OH)3=AlO2-+2H2O、3OH-+Al3+=Al(OH)3 ↓计算n(Al3+)及和铝离子反应的氢氧根离子的物质的量,沉淀量最大时,根据2OH-+Mg2+=Mg(OH)2 ↓计算镁离子的物质的量;
(3)沉淀溶解过程中发生的反应为:氢氧化铝和氢氧根离子生成偏铝酸根离子和水的反应;
(4)溶液中的钾离子无法确定,根据焰色反应可以判断是否存在.
解答 解:该溶液为无色透明溶液,则溶液中不含Fe3+、Cu2+,向溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则溶液中存在Cl-;向溶液中加入氢氧化钠溶液,根据图象知,先随着加入氢氧化钠量的增多,沉淀的量增大,当达到一定程度后,再加入氢氧化钠,沉淀的量减少,但最终还有白色沉淀,说明溶液还含有Al3+、Mg2+,则溶液中不含CO32-、OH-;
(1)根据以上分析可知,溶液中一定存在Cl-、Al3+、Mg2+,不存在的离子为Fe3+、Cu2+、OH-、CO32-;
故答案为:Cl-、Al3+、Mg2+;Fe3+、Cu2+、OH-、CO32-;
(2)根据(1)分析知,溶液中含有Cl-、Al3+、Mg2+,所以溶液中最少含有两种物质:MgCl2、AlCl3,根据OH-+Al(OH)3=AlO2-+2H2O知,n(Al(OH)3 )=(3.6-3)mol=0.6mol,根据原子守恒知,n(AlCl3)=n(Al(OH)3 )=0.6mol,根据3OH-+Al3+=Al(OH)3 ↓知,生成氢氧化铝需要n(NaOH)=1.8mol,则生成氢氧化镁需要的n(MaOH)=(3-1.8)mol=1.2mol,根据2OH-+Mg2+=Mg(OH)2 ↓知,n(Mg2+)=0.6mol,根据原子守恒知,n(MgCl2)=0.6mol,所以n(AlCl3):n(Mg2+)=0.6mol:0.6mol=1:1,
故答案为:MgCl2;AlCl3;1:1;
(3)沉淀溶解过程中发生的反应为:氢氧化铝和氢氧根离子生成偏铝酸根离子和水的反应,离子反应方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)溶液中的钾离子无法确定,钾元素的焰色反应为紫色,所以可以通过焰色反应判断是否存在,其操作为:用洁净铂丝蘸取少量溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,则溶液中含K+,若没有观察到火焰呈紫色,则溶液中不含K+;
故答案为:用洁净铂丝蘸取少量溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,则溶液中含K+,若没有观察到火焰呈紫色,则溶液中不含K+.
点评 本题考查了镁铝化合物的有关计算,根据溶液的颜色、离子共存等来确定溶液中存在的离子,再结合图象分析溶液中存在物质的含量,注意氢氧化铝的两性,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小 | |
| B. | 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl) | |
| C. | 物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+c(HX)=0.02 mol/L | |
| D. | 己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
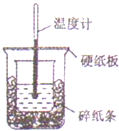 50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60ml0.5mol•L-1盐酸跟50ml0.55mol•L-1NaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 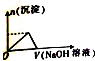 | B. | 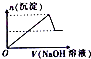 | C. | 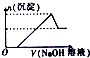 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要摄入反式脂肪酸,就一定会患上心血管疾病 | |
| B. | 氢化是一种把液态植物油转化成固态或半固态脂肪的化学工艺 | |
| C. | 奶油、代可可脂巧克力、乳饮料、奶茶、蛋黄派等零食都可能含有反式脂肪酸 | |
| D. | 食品标签里的氢化植物油、植脂末、起酥油、代可可脂等都可能是反式脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+H2O?H2SO3 | B. | SO2+2NaOH?Na2SO3+H20 | ||
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | D. | SO2+CaO═CaSO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com