
����Ŀ��CS2��һ�ֳ����ܼ�������������������ճ����ά�ȡ��ش��������⣺
(1)CS2������KMnO4��Һ��Ӧ������ΪCO2�������Σ��÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ__________(MnO4������ԭΪMn2��)��
(2)������Ƿ���ȡCS���ķ�ӦΪCH4(g)��2S2(g)![]() CS2(g)��2H2S(g) ��H
CS2(g)��2H2S(g) ��H
���ں��º����ܱ������н��и÷�Ӧʱ����˵���÷�Ӧ�Ѵﵽƽ��״̬����_________(����ĸ)��
A.v��(S2)��2v��(CS2)
B.������������ܶȲ�����ʱ��仯
C.�������������ѹǿ������ʱ��仯
D.��λʱ���ڶ���C��H����Ŀ�����H��S����Ŀ���
����֪���м������ݣ�
���ۼ� | C-H | S=S | C=S | H-S |
����/ | 411 | 425 | 573 | 363 |
�÷�Ӧ����H��_________kJ��mol��1��
(3)��һ�ܱ������У���ʼʱ��������г���H2S��CH4��n(H2S)��n(CH4)��2��1��������Ӧ��CH4(g)��2H2S(g)![]() CS2(g)��4H2(g)��0.1MPaʱ���¶ȱ仯��ƽ��ʱ��������ʵ���������Ӱ����ͼ��ʾ��
CS2(g)��4H2(g)��0.1MPaʱ���¶ȱ仯��ƽ��ʱ��������ʵ���������Ӱ����ͼ��ʾ��
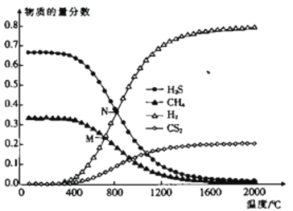
�ٸ÷�Ӧ��H_________(����>������<��)0��
��M���Ӧ�¶��£�H2S��ƽ��ת����Ϊ_________��Ϊ���H2S��ƽ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ��___________________________(�о�һ��)��
��N�㣬ƽ���ѹp(CS2)��_________MPa����Ӧ�¶��£��÷�Ӧ��Kp��_________(MPa)2��(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��)
���𰸡�5:16 AD -104 > 20% ��С��ʼʱ![]()
![]()
![]()
��������
��1���������⣬CS2������Ϊ�����Σ�ÿ��S�Ļ��ϼ���-2������+6�ۣ�ת�Ƶ�����Ϊ8��2��Sת�Ƶ�����Ϊ16��MnO4������ԭΪMn2����ÿ��Mnת�Ƶ�����Ϊ5������������ԭ��Ӧת�Ƶ������غ㣬��ԭ����CS2������������MnO4���������ʵ���֮��Ϊ5:16��
��2����A��v��(S2)��2v��(CS2)����Ӧ���ʷ��ϻ�ѧ������֮�ȣ��Ҽ�������Ӧ���������淴Ӧ��
��A��ȷ��
B��������ܶ�![]() ����Ӧ��������ﶼ�����壬���������غ㣬mΪ��ֵ����������̶���V���䣬��
����Ӧ��������ﶼ�����壬���������غ㣬mΪ��ֵ����������̶���V���䣬��![]() �Ǹ���ֵ�����������ж���ѧƽ�⣬B����
�Ǹ���ֵ�����������ж���ѧƽ�⣬B����
C�����ڷ�ӦCH4(g)��2S2(g)![]() CS2(g)��2H2S(g)ǰ������������䣬�������е�ѹǿҲ���䣬����ѹǿ���������ж�ƽ�⣬C����
CS2(g)��2H2S(g)ǰ������������䣬�������е�ѹǿҲ���䣬����ѹǿ���������ж�ƽ�⣬C����
D������C��H��������Ӧ������H��S�����淴Ӧ����CH4��H2S������֮��Ϊ1:2����ѧ����Ŀ֮��Ϊ1:1����λʱ���ڶ���C��H����Ŀ�����H��S����Ŀ��ȣ�˵����Ӧ���ʷ���ϵ���ȣ�D��ȷ��
��ѡAD��
���ʱ�����÷�Ӧ����ܼ��ܼ�ȥ��������ܼ��������㣬![]() ��
��
��3������ͼ���֪���¶�����ʱ��ƽ���������ƶ���������Ӧ���ȣ�![]() >0��
>0��
���迪ʼʱͶ���CH4�����ʵ���Ϊ![]() ��H2S�����ʵ���Ϊ2
��H2S�����ʵ���Ϊ2![]() ����Ӧ��CH4�����ʵ���Ϊ
����Ӧ��CH4�����ʵ���Ϊ![]() ������
������
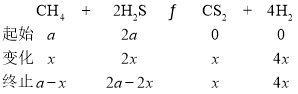
M��ʱ��CH4��H2S���ʵ�����ȣ�����![]() ����H2Sת����Ϊ
����H2Sת����Ϊ![]() ������H2S��ת���ʿ������CH4��Ͷ�ϱȣ�����С��ʼʱ
������H2S��ת���ʿ������CH4��Ͷ�ϱȣ�����С��ʼʱ![]() ��
��
���迪ʼʱͶ���CH4�����ʵ���Ϊ![]() ��H2S�����ʵ���Ϊ2
��H2S�����ʵ���Ϊ2![]() ����Ӧ��CH4�����ʵ���Ϊ
����Ӧ��CH4�����ʵ���Ϊ![]() ������
������
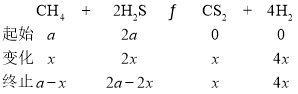
N��ʱ��H2S��H2���ʵ�����ȣ�����![]() �����
�����![]() �����Է�Ӧ��������ʵ���Ϊ
�����Է�Ӧ��������ʵ���Ϊ![]() ��ƽ���CS2�ķ�ѹΪ
��ƽ���CS2�ķ�ѹΪ![]() ��
��
ƽ�ⳣ��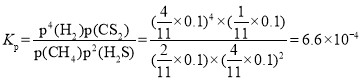 ��
��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڻ��Ϸ�Ӧ����
A.Zn+2AgNO3=Zn(NO3)2+2AgB.2FeCl2+Cl2=2FeCl3
C.Cu(OH)2+2HCl=CuCl2+2H2OD.CaCO3![]() CaO+CO2��
CaO+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�CO��ˮ�����ֱ�Ϊ1 mol��3 mol�����ܱ������з�����ӦCO��H2O(g)![]() CO2��H2����ƽ�����CO2Ϊ0.75 mol����ͨ��6 molˮ�������ﵽ�µ�ƽ���CO2��H2�����ʵ���֮�Ϳ���Ϊ
CO2��H2����ƽ�����CO2Ϊ0.75 mol����ͨ��6 molˮ�������ﵽ�µ�ƽ���CO2��H2�����ʵ���֮�Ϳ���Ϊ
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȾԽ��Խ��Ϊ���ǹ�ע�����⣬�����е�NOx�����ѳ�(������)֮������ŷš�
��1��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺�� ��ӦCO(g)��H2O(g) ![]() H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
�¶�/�� | 400 | 500 | 830 | 1 000 |
ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�ٴ��ϱ������ƶϣ��˷�Ӧ��__________(����������������)�ȷ�Ӧ��
����830 ���£�����ʼʱ������ܱ������г���CO��H2O��Ϊ1 mol����ﵽƽ���CO��ת����Ϊ________��
��2��������β��ϵͳ��װ�ô�ת����������Ч����NOx��CO���ŷš�
��֪����2CO(g)��O2(g) ![]() 2CO2(g) ��H��566.0 kJ��mol1
2CO2(g) ��H��566.0 kJ��mol1
��N2(g)��O2(g) ![]() 2NO(g) ��H��+180.5 kJ��mol1
2NO(g) ��H��+180.5 kJ��mol1
��2NO(g)��O2(g) ![]() 2NO2(g) ��H��116.5 kJ��mol1
2NO2(g) ��H��116.5 kJ��mol1
�ش��������⣺
��CO��ȼ����Ϊ _________�� ��1 mol N2(g)��1 mol O2(g) �����л�ѧ������ʱ�ֱ���Ҫ����946 kJ��498 kJ����������1 mol NO(g) �����л�ѧ������ʱ�����յ�����Ϊ_________kJ��
��д��CO��NO2��ԭΪ���ʷ�Ӧ���Ȼ�ѧ����ʽΪ__________________________________________
��3�������������ϵĴ�ת����������������CO��NO2��ԭΪ���ʷ�Ӧ����һ���¶��£���һ������CO��NO2����2L�̶��ݻ��������У��ش��������⣺
�ٴӷ�Ӧ��ʼ��5min��������0.08mol N2����5min����(CO)=___________________molL1min1��
��25minʱ������Ũ�ȱ仯��ͼ��ʾ����ı������������___________(����ĸ���)��
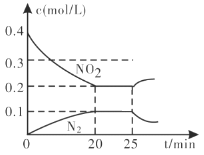
A.��С������� B.����NO2��Ũ�� C.�����¶� D.�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2��g����2ICl��g��=I2��g����2HCl��g�����÷�Ӧ�֢١����������У�������������ͼ��ʾ�� ��֪��ICl����Ϊ��1�ۣ���Ϊ+1�ۡ������й�˵����ȷ����
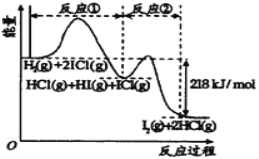
A.��Ӧ��Ϊ���ȷ�Ӧ
B.��Ӧ�ٺ͢ھ���ͬ��Ԫ�ؼ䷢����������ԭ��Ӧ
C.��Ӧ�ٱȷ�Ӧ�ڵ�������������Ӧ����Ӧ�Ļ���й�
D.HI��g����ICl��g�� ![]() I2��g����HCl��g�� ��H����218 kJ/mol
I2��g����HCl��g�� ��H����218 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ұ�𡢹���������������ȱ�ٵĿ����Դ�����еĸ�������Ψһ�ɿ��ɵĸ���ʯ����ҵ�ϳ��ø�������Ҫ��Fe2O3��FeO��Cr2O3,������MgO��Al2O3��SiO2�����ʣ�Ϊԭ���Ʊ��ظ���غ���������������������ͼ��ʾ��

��֪�������ӿ�ʼ���ɳ����ͳ�����ȫ��pH���±���ʾ��

��ش��������⣺
(1)������������ NaOH �� NaCIO3�ķ�Ӧ���������н��еģ����������������ϵ���___________.
A.�� B.����Al2O3) C. �մ� D.ʯӢ
(2)д���������е�Cr2O3������ NaOH��NaCIO3��Ӧ�Ļ�ѧ����ʽ��___�������ڸù�������Ԫ�ػ����ת��ΪNaFeO2,���Լ�ˮ������Ϊ__________________�������ӷ���ʽ��ʾ����
(3)������ 2������Ҫ�ɷ�Ϊ_________���ѧʽ����
(4)���û�ѧƽ���ƶ�ԭ�����͵���pH2Լ��4.5��ԭ���ǣ��������м���KC1���壬����Ũ����Һ������о�Ĥ��������ȴ�ᾧ�����˵õ����ظ���ؾ��塣Ϊ��øߴ����ظ���ؾ��壬�ɲ�ȡ___________����������ƣ���
(5)����pH3�ķ�ΧΪ__________
(6)��֪��������������Ԫ�ص�������Ϊ14:13.������������Ԫ��ת��ΪFe2O3��������Ϊ60%,��ȡ��Ԫ�ص�ת����Ϊ90%,����õ�Fe2O3������Ϊ32t,������Ʊ�K2Cr2O7������Ϊ______t(�������1λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪2P4+9KOH+3H2O�T3K3PO4+5PH3��Ӧ����������______�� �������뻹ԭ�����ʵ���֮����_________������������____________��
��2������˫���ŷ�������з�Ӧ����ת�Ƶķ������Ŀ10Al+6NaNO3 +4NaOH�T10NaAlO2 +3N2��+2H2O______________________
��3��Mn2+��Bi3+��BiO3����MnO4����H+��H2O��ɵ�һ��������ԭϵͳ�У�����BiO3����Bi3+�ķ�Ӧ���̣��ݴ˻ش��������� ����������ԭ��Ӧ�У�����ԭ��Ԫ����____________��
���뽫����������ԭ���Ļ�ѧʽ����ƽ��ķ���ʽ����������Ӧ��λ���У����õ����ŷ��������ת�Ƶķ������Ŀ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�Ļ�������������������������Ҫ�����á�
��1����֪��2CO(g)+O2(g)![]() 2CO2(g) ��H1=��566kJ��mol��1
2CO2(g) ��H1=��566kJ��mol��1
H2O(g)+CO(g)![]() H2(g)+CO2(g) ��H2=��41kJ��mol��1
H2(g)+CO2(g) ��H2=��41kJ��mol��1
CO(g)+2H2(g)![]() CH3OH(g) ��H3=��107kJ��mol��1
CH3OH(g) ��H3=��107kJ��mol��1
��CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) ��H=___kJ��mol��1
CO2(g)+2H2O(g) ��H=___kJ��mol��1
��2��T��ʱ�����ݻ���Ϊ2L��A��B�����ܱ������о�ͨ��4.0molCO2��6.8molH2��������Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-50kJ��mol��1��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У����A������CO2��ת���� �� (CO2) ��ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=-50kJ��mol��1��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У����A������CO2��ת���� �� (CO2) ��ʱ��ı仯��ͼ��ʾ��

����0~5min��A������v(CH3OH)=___�����¶���������Ӧ��ƽ�ⳣ��K=___(������λ��Ч����)��
�ڷ�Ӧ��ʼ��ƽ��Ĺ����У�A��B��������CO2���������ʵĴ�С��ϵΪv(A)___(����>����<������=��)v(B)��
�۷�Ӧ�����У����и���ָ���ܱ���A�����з�Ӧ��v��>v������___(����)
a.��ϵ�ڵ�ѹǿ����
b.�����ƽ����Է�����������
c.����H��H������Ŀ���γ�C��O����Ŀ��2��
d.v��(CO2)=v��(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧΪ̽����������Ļ�ѧ���ʣ��������ͼ��ʾ��װ�á�
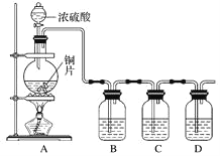
��ش��������⣺
��1��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ___��
��2��Bƿ��ʢ��Ʒ����Һ���۲쵽Ʒ����Һ��ɫ��������ΪSO2����__(����ĸ����ͬ)��Cƿ��ʢ�����Ƶ���ˮ���۲쵽��ˮ��ɫ��������ΪSO2����__��
A�������� B����ԭ�� C��Ư����
��3��Dƿ��ʢ��NaOH��Һ��������___��
��4����ַ�Ӧ��С��ͬѧ����ͭ�����ᶼ��ʣ�ࡣ����ʹʣ���ͭƬ�ܽ⣬���ټ���__(����ĸ)��
A��HNO3 B��NaNO3 C��Fe2O3 D��Na2CO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com