
如果类似于水的离子积Kw,溶液中c(Ag+)和c(Cl﹣)的乘积是一个常数:c(Ag+)•c(Cl﹣)=1.0×10﹣10,当溶液中c(Ag+)•c(Cl﹣)大于1.0×10﹣10时,才可能产生AgCl沉淀.现向50mL 0.018mol•L﹣1的AgNO3溶液中加入50mL 0.02mol•L﹣1的盐酸,生成了沉淀.求:
(1)沉淀生成后溶液中c(Ag+)是多少?
(2)沉淀生成后溶液的pH是多少?
(3)如果向沉淀生成后的溶液中再加入50mL 0.001mol•L﹣1的盐酸,将会观察到什么现象?
考点:
难溶电解质的溶解平衡及沉淀转化的本质.
专题:
电离平衡与溶液的pH专题.
分析:
(1)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(2)沉淀后溶液中剩余氢离子浓度,计算pH;
(3)根据溶液中c(Ag+)•c(Cl﹣)与Ksp的大小关系分析.
解答:
解:(1)向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,混合后两者浓度分别为c(Ag+)=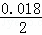 mol/L=0.009 mol/L、c(Cl﹣)=
mol/L=0.009 mol/L、c(Cl﹣)=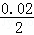 mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01﹣0.009=0.001mol/L,
mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01﹣0.009=0.001mol/L,
Ksp=c(Ag+)×C(Cl﹣)=1.0×10﹣10,则:c(Ag+)=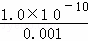 =1.0×10﹣7mol/L,
=1.0×10﹣7mol/L,
答:沉淀生成后溶液中c(Ag+)是1.0×10﹣7mol/L;
(2)沉淀生成后,氢离子浓度c=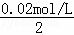 =0.01mol/L,所以pH=2,
=0.01mol/L,所以pH=2,
答:沉淀生成后溶液的pH是2;
(3)向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,则溶液体积为0.15L,
c(Ag+)=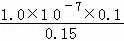 =
=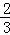 ×10﹣7mol/L,
×10﹣7mol/L,
c(Cl﹣)=0.001mol/L,
则c(Ag+)•c(Cl﹣)=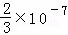 ×0.001=
×0.001=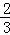 ×10﹣10<Ksp=1.0×10﹣10,所以不产生沉淀;
×10﹣10<Ksp=1.0×10﹣10,所以不产生沉淀;
答:不产生沉淀,因为在溶液中c(Ag+)•c(Cl﹣)<Ksp,溶液未饱和.
点评:
本题考查溶液浓度的计算,本题难度不大,做题时注意判断两种物质的反应程度,再根据溶度积常数计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
②无色溶液中:K+、Na+、MnO4﹣、SO42﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3﹣、NO3﹣、Cl﹣
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、Br﹣.
|
| A. | ①⑤ | B. | ②③ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,则此温度下反应①的平衡常数为( )
|
| A. | 9 | B. | 16 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同? .
(2)写出实验3中的电极反应式和电池总反应方程式.铝电极 . 石墨电极 电池总反应: .
(3)实验4中的铝作正极还是负极? ,为什么? .
(4)实验5中,负极反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,下列三种溶液:①0.001 mol·L-1氨水与0.001 mol·L-1 HCl溶液等体积混合液 ②pH=3的HCl溶液与pH=11的NaOH溶液等体积混合液 ③pH=11的氨水与pH=3的HCl溶液等体积混合液。其pH大小关系正确的是 ( )。
A.①=②=③ B.①>②>③
C.①<②=③ D.①<②<③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水的电离平衡曲线如图所示,
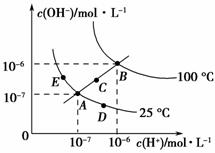
试回答下列问题:
(1)图中五点的KW间的关系是______________________________________。
(2)若从A点到D点,可采用的措施是________。
a.升温
b.加入少量的盐酸
c.加入少量的NH4Cl
(3)点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在现代化学分析测试中,常借助一些仪器来分析化学物质的组成.下列有关说法不正确的是()
A. 用红外光谱仪确定物质中是否存在Na+、K+、Cu2+等离子
B. 用元素分析仪确定物质中是否含有C、H、O、N、S等
C. 用原子吸收光谱确定物质中含有哪些金属元素
D. 用pH计来测量溶液的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应化学方程式,并写出该反应属于何反应类型.
(1)乙烯使溴水退色 ;
(2)实验室制取乙烯的反应 ;
(3)由乙炔制聚氯乙烯 nH ;
(4)乙烷与Cl2在光照条件下1:1反应 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com