
��18�֣�����ڹ�ũҵ������������Ҫ����;�������Ҫ��������и��⡣
��.ij��ѧ��ȤС����������װ����ѡȡ��Ҫ��װ����ȡ(NH4)2SO4��Һ��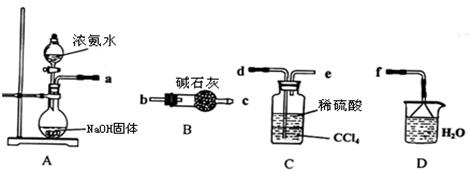
��1���������ӵ�˳���ýӿ������ĸ��ʾ���ǣ�a
��2���Դӵ���ƽ��Ƕȷ�����ʵ��װ��A���ܲ���������ԭ��
��
��3����װ��C������Һ����뿪�IJ��������� ��
��4��(NH4)2SO4���Ͷ����д̼��ԣ�����ʪ�ԡ���ʪ��̽�ɿ顱������Ӧע�� ��
��.Ϊ����Ȼ�淋ľ��ü�ֵ���ҹ���ѧ�����������������þ�ȷֽ��Ȼ���ư������õ���ʽ�Ȼ�þ[Mg(OH)Cl]�Ĺ��ա�ijͬѧ���ݸ�ԭ����Ƶ�ʵ��װ����ͼ��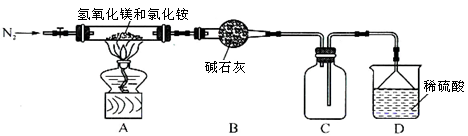
��ش��������⣺
��1��װ��A�з�����Ӧ���ɼ�ʽ�Ȼ�þ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�����г���ͨ��N2�����������㣺һ��ʹ��Ӧ�����İ�����ȫ��������ϡ���������գ�
���� ��
��3����MgCl2��Һ�����õ�MgCl2��6H2O���壬������Ŀ����_________��
a���õ��ȱ�����Һ b����������
��4��þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ��������ǣ�
��
����MgCl2��6H2O�Ʊ���ˮMgCl2�IJ����� ��Χ�н��У����ڿ����м��ȣ��������Mg(OH)Cl��
(18��)
��1��d e f (2��)
��2���������Ƶ������OH�������˰�ˮ��OH��Ũ�ȣ���ʹ��ˮ����ƽ��NH3+H2O  NH4++OH�����ƣ����������ݳ���(2��)
NH4++OH�����ƣ����������ݳ���(2��)
��3�� ��Һ��2�֣���
��4���ܷ⡢������ͨ��(2��)
��1��Mg(OH)2+NH4Cl MgOHCl+NH3��+H2O(2��)
MgOHCl+NH3��+H2O(2��)
��2����ֹװ��C�е�AlCl3��Һ������װ��B(2��)
��3��a(2��)
��4�����ò�˿պȡ�������壬���ھƾ��ƻ���������,����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ��ơ���2�֣�������ɫ��ӦҲ���֣�
��HCl����������2�֣�
���������������1����ȡ�İ��������ᷴӦ��������泥�ʣ��İ�����ˮ���գ�������˳��Ϊa��d��e��f��
��2����ˮ�д��ڵ���ƽ�⣺ NH3+H2O  NH4++OH������NaOH��Ϻ�NaOH�����OH������ʹ��ˮ����ƽ�������ƶ������������ݳ���
NH4++OH������NaOH��Ϻ�NaOH�����OH������ʹ��ˮ����ƽ�������ƶ������������ݳ���
��3�����뻥�����ܵ�Һ��ķ����ǣ���Һ��
��4����Ϊ(NH4)2SO4���Ͷ����д̼��ԣ�����ʪ�ԡ���ʪ��̽�ɿ顱��Ӧ��ֹˮ�ֽ��룬���Դ���Ӧע���ܷ⡢������ͨ�硣
��1��������Ŀ������Ϣ����Ӧ��ΪMg(OH)2��NH4Cl��������ΪMgOHCl��NH3��H2O�����Ի�ѧ����ʽΪ��Mg(OH)2+NH4Cl MgOHCl+NH3��+H2O��
MgOHCl+NH3��+H2O��
��2����ֹװ��C�е�AlCl3��Һ������װ��B
��3����MgCl2��Һ�õ�MgCl2��6H2O����ķ���Ϊ����Ũ�������½ᾧ������������Ŀ���ǣ��õ��ȱ�����Һ����a����ȷ��
��4����NaԪ������ɫ��Ӧ���м������Բ��������ǣ��ò�˿պȡ�������壬���ھƾ��ƻ���������,����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ��ơ�
����ΪMgCl2Ϊǿ�������Σ�Mg2+����ˮ�ⷴӦ����HCl���������п�������MgCl2��ˮ�⣬������MgCl2��6H2O�Ʊ���ˮMgCl2�IJ�����HCl��Χ�н��С�
���㣺���⿼��ʵ�����������ʵ�鷽���ķ��������ʵļ��顢ƽ���ƶ��������ˮ�⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��Ļ������������Ϳ����з�������Ҫ���á�
��1��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ��ȡ���֪��SO2Cl2(g) SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
��2����ҵ���Ʊ�����Ĺ����д��ڷ�Ӧ��2SO2(g)��O2(g) 2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��
2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��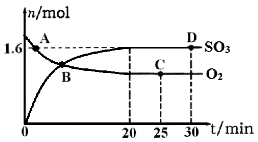
��0��20min��Ӧ��ƽ�����ʦ�(O2)��___________��
������������ȷ���� ��
a��A�����(SO2)������(SO2)
b��B�㴦��ƽ��״̬
c��C���D��n(SO2)��ͬ
d�������������䣬500��ʱ��Ӧ��ƽ�⣬n(SO3)��ͼ��D���ֵ��
��3����ҵ����Na2SO3��Һ���������е�SO2��������ͨ��1.0 mol��L��1��Na2SO3��Һ������ҺpHԼΪ6ʱ��Na2SO3��Һ����SO2�����������½���Ӧ�������ռ�����ʱ��Һ��c (SO32��)��Ũ����0.2 mol��L��1������Һ��c(HSO3��)��__mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�̶�������CO2������Ч��������Դ�������ٿ����е��������塣��ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�
CO2��g����3H2��g�� CH3OH��g����H2O��g��
CH3OH��g����H2O��g��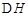 =-49��0kJ��mol
=-49��0kJ��mol
ij��ѧʵ��С�齫6mol CO2��8mol H2����һ�ݻ�Ϊ2L���ܱ������У��¶ȱ��ֲ��䣩�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩���ش��������⣺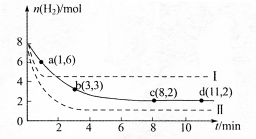
��1���÷�Ӧ��0~8min��CO2��ƽ����Ӧ������ mol��L-1��min-1
��2�����¶��¸÷�Ӧ��ƽ�ⳣ��K����ֵΪ ��
��3�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ��
��ʵ����ȣ����ߢ�ı������������ �����ߢ�ı������������ ����ʵ�߶�Ӧ������ƽ�ⳣ��Ϊ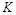 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ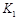 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ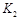 ����
���� ��
�� ��
�� �Ĵ�С��ϵ�� ��
�Ĵ�С��ϵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
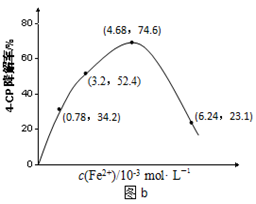
��16�֣�Na2S2O8��Һ�ɽ����л���Ⱦ��4-CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4-����ͨ���ⶨ4-CP�����ʿ��ж�Na2S2O8��Һ������SO4-����������ij�о�С��̽����Һ����ԡ�Fe2+��Ũ�ȶԲ�����SO4-������Ӱ�졣
��1����Һ����Ե�Ӱ�죺����������ͬ����4-CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ�� ���� �������ڡ������ڡ���Na2S2O8����SO4-����
��2��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c(4-CP)=1.56��10-4 mol��L��1��c(Na2S2O8)=3.12��10-3 mol��L��1�Ļ����Һ�С���Ӧ240 min����ʵ������ͼb��ʾ��
��֪ S2O82- + Fe2+= SO4-��+ SO42- + Fe3+��������ܻᷢ����SO4-�� + Fe2+��SO42- + Fe3+
�� ʵ�鿪ʼǰ������FeSO4��Һ�Ƿ��������Լ��� ����ѧʽ�����类�������Թ۲쵽�������� ��
�ڵ�c(Fe2+)��3.2 ��10-3 mol��L��1ʱ��4-CP������Ϊ %��4-CP�����ƽ����Ӧ���ʵļ������ʽΪ ��
�۵�c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij���Թ�ҵ��ˮ�к���K2Cr2O7�������£�����(H2C2O4)�ܽ����е�Cr2O72��ת��ΪCr3����ij�������о����֣�����������[Al2Fe(SO4)4��24H2O]���ɶԸ÷�Ӧ������á�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
(1)��25 ���£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�飬�������ʵ����Ʊ�(���в�Ҫ���ո�)��
| ʵ���� | ��ʼpH | ��ˮ��Ʒ���/mL | ������Һ���/mL | ����ˮ���/mL |
| �� | 4 | 60 | 10 | 30 |
| �� | 5 | 60 | 10 | 30 |
| �� | 5 | 60 | | |
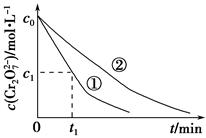
| ʵ�鷽��(��Ҫ��д�����������) | Ԥ��ʵ�����ͽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ1��2��ʾ��ʵ�顣��ش�������⡣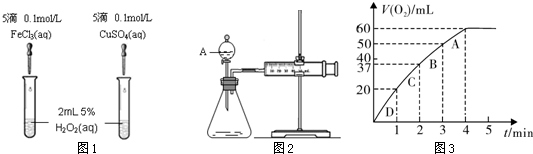
��1�����Է�������ͼ1��ͨ���۲� �����ԱȽϵó����ۡ���ͬѧ�����FeCl3��Ϊ0.05 mol/L Fe2(SO4)3��Ϊ�������������� ��
��2��������������ͼ2��ʾ��ʵ��ʱ������40 mL���壬��������Ӱ��ʵ������ؾ��Ѻ��ԡ�ʵ������Ҫ������������ ��
��3������0.10 mol MnO2��ĩ��50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ3��ʾ��
��д��H2O2�ڶ������������·�����Ӧ�Ļ�ѧ����ʽ ��
��ʵ��ʱ�ų������������� mL��
��A��B��C��D���㷴Ӧ���ʿ�����˳��Ϊ�� �� �� �� ��
���ͷ�Ӧ���ʱ仯��ԭ�� ��
��H2O2�ij�ʼ���ʵ���Ũ���� ���뱣����λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء���ѡ�Լ���1.00 mol��L-1 HNO3��2.00 mol��L-1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35 ��ˮԡ��
(1)�����������Щ���ض�����Ӱ���̽��?
____________________________________________________________��
(2)������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
(3)����ʵ����Ӧ���ƵIJ�������������Һ����� ��
(4)��ʵ��С������ͼʵ��װ�ý���ʵ�顣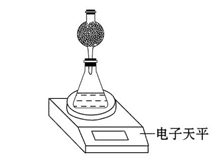
�ٳ�������ƽ������ܡ���ƿ��ҩ�ס������������⣬�����ʵ���������� ��
�ڸ������Ӧ���õ��Լ��� ��
| A����ʯ�� | B����ˮCaCl2 |
| C��P2O5���� | D��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�������ˮ�ⷴӦ����ʽΪ��HCOOCH3 + H2O  HCOOH + CH3OH �C Q��Q>0��
HCOOH + CH3OH �C Q��Q>0��
ijС��ͨ��ʵ���о��÷�Ӧ����Ӧ����������仯���Բ��ƣ�����Ӧ��ϵ�и���ֵ���ʼ�����±����������ת�������¶�T1���淴Ӧʱ�䣨t���ı仯����ͼ��
| ��� | ���ʵ���/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
0.02mol��L��1��HCN��Һ��0.02mol��L��1��NaCN��Һ�������ϣ���֪�����Һ��C(CN��)<C(Na��)�������й�ϵ�У���ȷ���ǣ� ��
| A��C(Na��)>C(CN��)>C( H��)>C(OH�D) | B��C(HCN)+C (CN��)=0.04mol��L��1 |
| C��C(Na��)+C(H��)= C(CN��)+C(OH�D) | D��C(CN��)>C(HCN) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com