考点:元素周期律和元素周期表的综合应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:由元素在周期表中位置,可知E为氢、G为Li、Q为碳、R为氮、M为氧、J为Na、T为Fe、X为Cu.
(1)根据核外电子排布规律书写Fe
3+的核外电子排布式;
(2)同周期自左而右第一电离能呈增大趋势,但原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
(3)NO
+与N
2核外等电子体,NO
+中N与O之间形成3对共用电子对,各原子满足8电子结构;
(4)①Li、Na都属于金属晶体,金属性越强,单质熔点越高;
②钠与水反应反应;
③Na
2O
2含有离子键、共价键,与水反应生成氢氧化钠与氧气,要破坏离子键和共价键;
④根据氢键进行分析解答;
⑤一个C
2H
4分子中含有1个C=C双键、4个C-H单键,单键为σ键,双键含有1个σ键、1个π键;
(5)HC
9N分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则一定存在C≡C和C≡N键;
(6)G与R单质直接化合生成一种离子化合物Li
3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子数目为6×
=2,结合化合物化学式判断.
解答:
解:由元素在周期表中位置,可知E为氢、G为Li、Q为碳、R为氮、M为氧、J为Na、T为Fe、X为Cu.
(1)T为Fe,Fe
3+的核外电子为23,其电子排布为1s
22s
22p
63s
23p
63d
5,
故答案为:1s
22s
22p
63s
23p
63d
5;
(2)同周期从左向右第一电离能呈增大趋势,但N原子的2p电子为半满,为稳定结构,能量较低,所以N原子的第一电离能高于氧元素,C原子的最小,所以第一电离能为:N>O>C,故答案为:N>O>C;
(3)NO
+与N
2核外等电子体,NO
+中N与O之间形成3对共用电子对,电子式为:
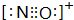
,故答案为:
;
(4)①G为Li,J为Na,都是金属晶体,离子半径越小,金属键越强,Li离子半径小,所以熔点高,故①正确;
②Na的活泼性强,首先与水反应,所以在溶液中不能置换出Cu,故②错误;
③J
2M
2为Na
2O
2,含有离子键、共价键,与水反应生成氢氧化钠与氧气,化学反应中化学键断裂,溶于水要破坏离子键和共价键,故③正确;
④氨气中存在氢键,所以氨气的沸点高于甲烷,故④错误;
⑤一个C
2H
4分子中含有4个C-H键,1个C=C键,含有五个σ键和一个π键,故⑤正确;
故答案为:①③⑤;
(4)HC
9N分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则一定存在C≡C和C≡N键,其结构式为H-C≡C-C≡C-C≡C-C≡C-C≡N,
故答案为:H-C≡C-C≡C-C≡C-C≡C-C≡N;
(5)G与R单质直接化合生成一种离子化合物Li
3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子数目为6×
=2,Li
3N中离子个数为3:1,所以层与层之间还原子为Li,故答案为:Li.
点评:本题是对物质结构的考查,涉及核外电子排布、电离能、等电子体、分子结构与性质、晶体类型与性质、常用化学应用、晶胞计算等,(4)、(5)为易错点和难点,较好的考查学生分析解决问题能力,题目难度中等.

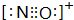 ,故答案为:
,故答案为: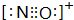 ;
;

