
����Ŀ��̼���仯������������������������ϵ��
��1����֪1g������ȫȼ�������ȶ���������ʱ�ų�Q kJ������,д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
��2����֪��C(s)��H2O(g)=CO(g)��H2(g) ��H����130 kJ��mol��1,
2C(s)��O2(g)=2CO(g) ��H����220 kJ��mol��1���Ͽ�1 mol H��H����O===O���ֱ���Ҫ����436 kJ��496 kJ����������Ͽ�1 mol O��H����Ҫ���յ�����Ϊ
A��332 kJ B��118 kJ
C��462 kJ D��360 kJ
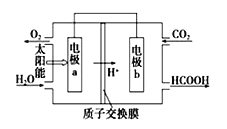
��3����CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ���ԭ����ͼ���缫a��b���淢���ĵ缫��Ӧʽ�ֱ�Ϊ��
a�� ��b�� ��
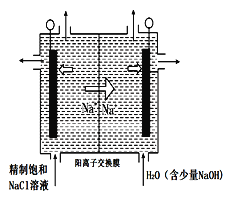
��4��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2���塣����������ClO2�ĵ缫��ӦʽΪ_______________________����ƽ���ƶ�ԭ������������pH�����ԭ��_____________��
���𰸡���1��CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H=-16QkJ/mol
��2��C��3��a��2H2O-4e-=O2��+4H+b��2CO2+4e-+4H+=2HCOOH
��4��2H2O+Cl--5e-=ClO2��+4H+������������2H����2e��===H2����H��Ũ�ȼ�С��ʹH2O![]() H����OH����ƽ�������ƶ���OH��Ũ��������pH������
H����OH����ƽ�������ƶ���OH��Ũ��������pH������
��������
�����������1����25�桢101kPa�£�1g����ȼ������CO2��Һ̬ˮʱ����QkJ����16g������ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�������Ϊ16QKJ�������ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-16QKJmol-1��
�ʴ�Ϊ��CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-16QKJmol-1��
��2����֪��C(s)+H2O(g)�TCO(g)+H2(g)��H=+130kJmol-1��
��2C(s)+O2(g)�T2CO(g)��H=-220kJmol-1
�١�2-�ڵã�2H2O(g)�TO2(g)+2H2(g)��H=(2��130+220)kJmol-1=480kJmol-1��
��O-H����ΪakJmol-1����4a-496-2��436=480�����a=462��ѡ��C��ȷ����ѡC��
��3����ͼ��֪�����Ҽ���ˮ�����������������ӣ��缫a���淢��������Ӧ��Ϊ�������缫��ӦʽΪ2H2O-4e-�TO2��+4H+������ͨ�������̼����������������HCOOH���缫b���淢����ԭ��Ӧ��Ϊ�������缫��ӦʽΪ2CO2+4e-+4H+�T2HCOOH��
��4���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ��ͬʱ���������ӣ��缫��ӦʽΪ��Cl--5e-+2H2O=ClO2��+4H+�����������H+Ũ�ȼ�С��ʹ��H2OOH-+H+��ƽ�������ƶ�����Һ��pH����
�ʴ�Ϊ��2H2O+Cl- -5e-=ClO2��+4H+������������2H����2e��===H2����H��Ũ�ȼ�С��ʹH2O![]() H����OH����ƽ�������ƶ���OH��Ũ������pH����
H����OH����ƽ�������ƶ���OH��Ũ������pH����


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����ϵͳ��������ȷ���ǣ�������
A.3������4���һ�����
B.3��3��4����������
C.3������5����ϩ
D.3��5����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ż�ʱ��������������
A. ��ϸɳ B. ʪĨ������ C. ˮ D. ��ĭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ײ��ϡ��ǵ�����Ͽ�ѧ�о���ǰ�أ�1����(nm)=10-9m�����о��ɹ��㷺Ӧ���ڴ������¿�ѧ�У������ײ��ϡ���ָ�о�����������ֱ���Ӽ���������ʮ���IJ��ϣ� �罫�����ײ��ϡ���ɢ��Һ���ɢ���У����û������ܾ��е��������� ��
A. �ж����ЧӦ B. ��ȫ������Ĥ
C. ��������ֽ D. ���÷�ɢϵ���ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͬ�����£���������ͭ���Է�������������Ӧ��
��)2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
��11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
����������ȷ����
A����Ӧ���У��������뻹ԭ�������ʵ���֮��Ϊ2:5
B����Ӧ���У�Cu3P���������������ǻ�ԭ����
C����Ӧ���У�����5mol CuSO4������Ӧʱ����ת�Ƶ���10mol
D����Ӧ����CuSO4������������Ӧ����CuSO4����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ƶõĵ�����(AlN)��Ʒ�г���������Al4C3��Al2O3��C�����ʡ�ijͬѧ���������ʵ��ֱ�ⶨ������(AlN)��Ʒ��AlN��Al4C3����������(����NH3��ǿ������Һ�е��ܽ�)��
��1��ʵ��ԭ�� ��Al4C3�����ᷴӦ������CH4;
��AlN����ǿ��������,����ǿ�����ɰ���,��д��AlN��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ: ��
��2��ʵ��װ��(����ͼ��ʾ)
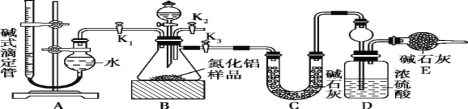
��3��ʵ�����
������ʵ��װ��,����װ�õ������ԡ��Ƶ�Dװ�õ�����Ϊy g,�ζ��ܵĶ���Ϊa mL��
�ڳ�ȡx g AlN��Ʒ������ƿ��;���ý���,�رջ���K2��K3,����K1,ͨ����Һ©������ϡ����,����ƿ�����ʳ�ַ�Ӧ����¼�ζ��ܵĶ���Ϊb mL��
�۴���Ӧ������ȫ��,�رջ��� ,���� ,ͨ����Һ©���������NaOH��Һ,����ƿ�����ʳ�ַ�Ӧ��
�� (����ò�Ӧ���еIJ���)���Ƶ�Dװ�õ�����Ϊz g��
��4�����ݷ�������AlN����������Ϊ ��
������ȡ�ζ�������������ʱ,Һ������ҵ�,�������������� (�ƫ��ƫС������Ӱ�족)��
��Al4C3����������Ϊ (�����ʵ�������µ�����Ħ�����ΪVm mol/L)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ϢϢ��أ�����˵����ȷ���ǣ� ��
A. ���Al3����Cu2����Hg2�����ؽ������ӻ�ʹ�����ʱ��Զ��ж�
B. ��ͥװ������ɢ�������ļ�ȩ��������Ⱦ���һ���
C. ����ȼ��ú̿����ȡů�������������γ�û�б�Ȼ��ϵ
D. þ��������������������ﶼ�����ʵ����²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(ÿ��1��)��.���ݽṹ���л�����з���,�����ڶ������ʵ����ա�
��1�������л������ڷ���������____________ (����ĸ),���뱽�Ĺ�ϵ��____________,д�������巢����Ӧ�Ļ�ѧ����ʽ��___________________________________,
Ԥ��÷�����____________ (������������������)�������෴Ӧ��
A��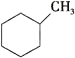 ��B��
��B�� ��C��
��C��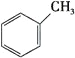
��2�������л����������������_________ (����ĸ)��
a��CH3CHO�� b��![]() c��
c�� 
��3�������л��������������_________ (����ĸ)��
A����֬�� B����ά�ء� C��������
��.���м���������,��Ϊͬλ�ص���____________,��Ϊͬ�����������___________,��Ϊͬϵ�����____________,��Ϊͬ���칹�����____________,����ͬ�����ʵ���____________��
��O2��O3�� ��35Cl��37Cl
��![]() ��
��![]() ��
�� ��
��
��CH3(CH2)2CH3��(CH3)2CHCH3 ���Ҵ�(CH3CH2OH)�ͼ���(CH3OCH3)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com