
硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙 B.平衡时,丙中c(SO3)是甲中的2倍
C.该温度下,平衡常数值为400 D.平衡时,SO2的转化率:α1<80%<α2
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 是植物生长的营养元素之一,也是蛋白质的重要组成元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)Y在周期表的位置为 。
(2)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________________。
(3)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(4)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料。化合物QX的制备可用Q的氧化物、焦炭和X的单质在1600 ~ 1750℃反应生成,已知每生成
1 mol QX,消耗1.5mol碳,写出该反应的化学方程式 。
(5)X、Y组成的一种无色气体遇空气变为红棕色。同温同压下,将该无色气体与氧气按一定体积比同时通入足量NaOH溶液中完全吸收,经测定,溶液中 NO3—、NO2—的物质的量比为1∶3,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据化学学科中的基本理论,请回答下列问题:
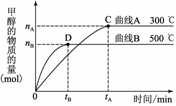 I、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。
I、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。
II、丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
 已知:
已知:
(1)写出丙烷的燃烧热的热化学方程式:
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.v正(H2) = v逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO,则平衡常数 (填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移
向 极(填“正”或“负”);电池的正极电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.加入铝粉能放出氢气的溶液中:CO32—、AlO2—、I—、NO3—
B.由水电离出的c(OH—)=10—13 mol·L—1的溶液中:Fe3+、NH4+、ClO—、Cl—
C.使pH试纸变红的溶液中:NH4+、Cu2+、SO42—、Cl—
D.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2—、Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为H2EO4
D.C的单质在空气中燃烧产物的化学式为C2O
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(3)CO—空气燃料电池中使用的电解质是搀杂Y2O3的ZrO2晶体,它在高温下能传导O2—。
该电池负极的电极反应式为 。
(4)甲醇也是新能源电池的燃料,但它对水质会造成一定的
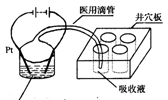 污染。有一种电化学法可消除这种污染。其原理是:2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧
污染。有一种电化学法可消除这种污染。其原理是:2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧 化成CO2而净化。实验室用右图装置模拟上述过程:
化成CO2而净化。实验室用右图装置模拟上述过程:
①检验电解时产生的CO2气体,井穴板穴孔内应盛放 溶液。
②写出净化甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关SO2说法中不正确的是
A.被酸雨污染的农田及湖泊可洒石灰石粉末;减轻其危害
B.在溶液BaCl2中通入SO2气体,溶液仍登清,滴入3%过氧化氢溶液有白色沉淀
C.能与水反应生成硫酸
D.二氧化硫能使品红溶液褪色,加热,品红溶液颜色恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种物质的焰色反应均为黄色。 A、B、C、D与盐酸反应均生成E,此外B还生成—种可燃性气体;而C、D还生成—种无色无味的气体H,该气体能使澄清的石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另—种无色无味气体。
请回答下列问题:
(1)写出B、C的化学式:B:___________________; C:___________________;
(2)写出F和H2O反应的化学方程式:__________________________________;
(3)写出下列反应的离子方程式
①D溶液+盐酸:_____________________________________________________;
②D溶液+A溶液:___________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将V1 ml 0.1 mol /L NaOH溶液和V2 ml 0.1 mol /L的CH3COOH溶液充分混合,若混合后溶液呈中性,则该混合溶液中有关粒子的浓度应满足的关系是
A.c (Na+)= c (CH3COO-)+c (CH3COOH) B.c (Na+)>c (CH3COO-)
C.c (Na+) + c (H+)=c (CH3COO-) D.c (Na+)=c (CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com