
【题目】下图表示的是物质A—H相互间的关系(“→”表示物质间的转化关系,“——”表示两端的物质能发生化学反应)。A、G都是常见单质,气体C常用于灭火,D是纯碱,E是熟石灰,F是一种蓝色溶液,可用于配制农药波尔多液。请你回答:
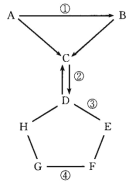
(1)C的化学式__________,H可能是 __________。
(2)写出标号①、②、③、④的化学方程式:
①_____________;②___________ ;
③______________;④__________。
【答案】CO2 HCl 2C+O2![]() 2CO 2NaOH+CO2=Na2CO3+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Fe+CuSO4=Cu+FeSO4
2CO 2NaOH+CO2=Na2CO3+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Fe+CuSO4=Cu+FeSO4
【解析】
C常用来灭火,可知C为二氧化碳,A和B在一定条件下都能生成C,可以知道B为一氧化碳,而A为氧气或是碳单质;D是纯碱,E是熟石灰,F是一种蓝色溶液,可用于配制农药波尔多液,则F为硫酸铜;G是常见单质,能够与硫酸铜反应,则G是比铜活泼的金属,如铁等;H能够与碳酸钠反应,也能与活泼金属反应,则H可能为酸,据此分析解答。
(1)根据C常用来灭火,可知C为二氧化碳;D是纯碱,F为硫酸铜;G是常见单质,能够与硫酸铜反应,则G是比铜活泼的金属,如铁等;H能够与碳酸钠反应,也能与活泼金属反应,则H可能为酸,如稀硫酸或盐酸,故答案为:CO2;HCl(或H2SO4);
(2)根据上述分析,C为二氧化碳,可以知道A为氧气或是碳单质,B为一氧化碳,D是纯碱,E是熟石灰,F为硫酸铜,H为盐酸或硫酸, G是活泼的金属,如铁等;因此反应①:2C+O2 ![]() 2CO;反应②:2NaOH+CO2=Na2CO3+H2O;反应③:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;反应④:Fe+CuSO4=Cu+FeSO4,故答案为:2C+O2
2CO;反应②:2NaOH+CO2=Na2CO3+H2O;反应③:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;反应④:Fe+CuSO4=Cu+FeSO4,故答案为:2C+O2 ![]() 2CO;2NaOH+CO2=Na2CO3+H2O;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;Fe+CuSO4=Cu+FeSO4。
2CO;2NaOH+CO2=Na2CO3+H2O;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;Fe+CuSO4=Cu+FeSO4。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
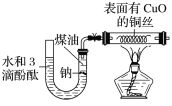
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的有效回收利用,既能够缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。请回答下列问题:
(1)CO2的电子式为___________。
(2)Zn/ZnO热化学循环还原CO2制CO的原理如下图:
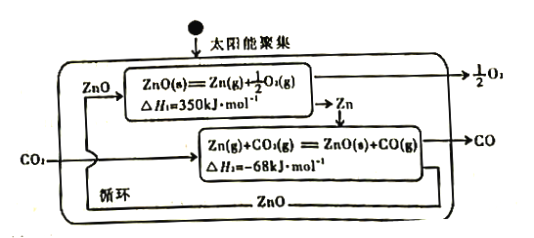
①从循环结果看,能量转化的主要方式是_________________________________。
②反应2CO2(g)=2 CO(g) +O2(g) △H=___________kJ·mol-1。
(3)二甲醚是重要的有机中间体,在一定条件下利用CO2与H2可直接合成二甲醚:
2CO2(g)+6H2(B)![]() CH3OCH3(g)+3H2O(g),当n(H2)/n(CO2)=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
CH3OCH3(g)+3H2O(g),当n(H2)/n(CO2)=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
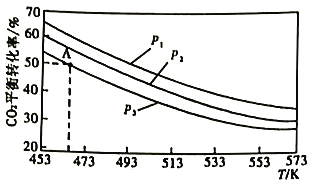
①该反应的△H___________0(填“>”或“<")。
②上图中的压强(p)由大到小的顺序为___________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应上图中的A点,则在此温度下,该反应的化学平衡常数为___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。
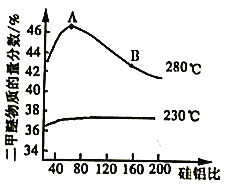
图中A点和B点的化学平衡常数比较:KA___________KB(填“>、=、<")。根据以上两条曲线,写出其中一条变化规律:____________________________________________。
(4)利用电化学原理将H2O和CO2转化为O2和燃料(C3H8O)的实验装置如下图所示。a电极的电极反应式为_________________________________。
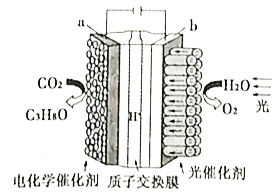 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关,A的产量通常用来衡量一个国家的石油化工水平.根据下面转化关系回答下列问题:
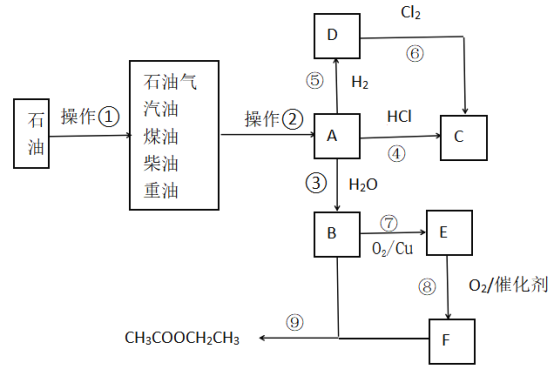
(1)操作①、操作②的名称分别为_________、_________.
(2)A的结构简式为_________.B、F分子中的官能团名称分别是___________、____________.
(3)写出反应③的化学方程式(注明条件):_____________________,反应类型为__________.
写出反应⑥的化学方程式(注明条件):_____________________,反应类型为__________.
写出反应⑦的化学方程式(注明条件):_____________________,反应类型为__________.
写出反应⑨的化学方程式(注明条件):_____________________,反应类型为__________.
(4)物质C的沸点为12.27 ℃,常用于局部冷冻麻醉应急处理.物质C可通过反应④和反应⑥制得,其中最好的方法是反应_______(填“④”或“⑥”),理由为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的阳离子Rn+,核外有x个电子,原子的质量数为A,则该元素原子的中子数为( )
A. A-x-nB. A-x+nC. A+x-nD. A+x+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的![]() ,发生反应
,发生反应![]() 。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,
。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,![]() 的浓度以
的浓度以![]() 的平均反应速率降低,经10s又达到平衡。
的平均反应速率降低,经10s又达到平衡。

完成下列填空:
(1)比较N、O的原子半径:![]() ________
________![]() (选填“
(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)在0-60s时段,反应速率![]() ________
________![]() 。
。
(3)若在相同情况下最初向该容器充入的是![]() 气体,要达到上述同样的状态,
气体,要达到上述同样的状态,![]() 的起始浓度是________mol/L。
的起始浓度是________mol/L。
(4)T_____100℃(选填“![]() ”或“
”或“![]() ”),判断理由是________________。
”),判断理由是________________。
(5)画出容器在80-90s时段内![]() 和
和![]() 的浓度变化________。
的浓度变化________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是________(用元素符号表示)。
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是________(填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式: ____。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:________。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该离子方程式___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com