
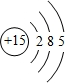 ,E的最高价含氧酸的化学式HClO4.
,E的最高价含氧酸的化学式HClO4.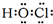 .
.分析 A、B、C、D、E为原子序数依次增大的短周期元素,A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,应是氢氧化铝、强酸、强碱之间反应,结合原子序数可知,A为Na、B为Al,均为第三周期元素,E原子最外层电子数为11-1-4=7,故E为Cl,C元素的最外层电子数比次外层电子数少4,则C元素最外层有4个电子,故C为Si元素,D元素原子次外层电子数比最外层电子数多3,则D元素最外层有5个电子,所以D为P元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素,A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,应是氢氧化铝、强酸、强碱之间反应,结合原子序数可知,A为Na、B为Al,均为第三周期元素,E原子最外层电子数为11-1-4=7,故E为Cl,C元素的最外层电子数比次外层电子数少4,则C元素最外层有4个电子,故C为Si元素,D元素原子次外层电子数比最外层电子数多3,则D元素最外层有5个电子,所以D为P元素.
(1)B的元素符号为Al,D为P元素,原子结构示意图为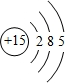 ,E为Cl元素,的最高价含氧酸的化学式为HClO4,
,E为Cl元素,的最高价含氧酸的化学式为HClO4,
故答案为:Al;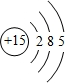 ;HClO4;
;HClO4;
(2)Cl元素+1价含氧酸为HClO,电子式为: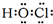 ,故答案为:
,故答案为: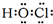 ;
;
(3)A、B两元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(4)非金属性Cl>P,故最高价氧化物对应水化物的酸性:HClO4>H3PO4,
故答案为:HClO4>H3PO4.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,次氯酸电子式的书写为易错点,学生容易受化学式影响,根据形成稳定结构需要形成共价键书写,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中燃烧产生苍白色火焰 | |
| B. | 铁丝在氯气中燃烧生成FeCl2 | |
| C. | 氯气的水溶液用于漂白,是利用氯气的强氧化性 | |
| D. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
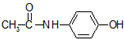 )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
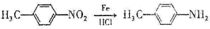 .
. ;
; ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li为电池的负极 | |
| B. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| C. | 电池的电解液可用LiCl水溶液代替 | |
| D. | 放电时电子从负极经外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com