
【题目】已知25℃时,H2SO3 的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A. 常温下,相同浓度的H2SO3 比HClO酸性强
B. 常温下,将NaHSO3溶液滴入到NaClO溶液中发生反应:HSO3-+ClO-=SO32-+HClO
C. 常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D. 将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
科目:高中化学 来源: 题型:
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
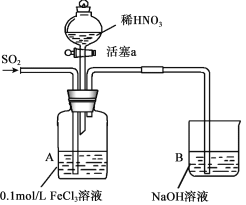
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):________。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因________。
(3)实验II中发生反应的离子方程式是__________________。
(4)实验III中,浅绿色溶液变为黄色的原因是__________________(用离子方程式表示)。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的化学方程式是______________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-。请从微粒变化的角度解释________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,用化学用语回答下列问题:

(1)元素Fe在周期表中的位置为________。
(2)⑦与⑧形成的化合物中各原子均满足8电子稳定结构的是_____。(用化学式表示)
(3)④、⑦、⑧三种元素的非金属性由强到弱的顺序是________。(用元素符号表示)
(4)用电子式表示含元素⑥的10电子二元化合物的形成过程________。
(5)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A是有机合成中重要的原料,由A制取高聚物M的流程如下:

请回答下列问题:
(1)反应②的反应类型为___________。
(2)E中的官能团名称是___________。
(3)反应②的条件是___________。
(4)写出A和F的结构简式:A___________;F___________。
(5)符合下列条件的E的同分异构体有___________种(不考虑立体异构)。
①含有相同官能团
②遇FeCl2能发生显色反应
③苯环上连有三个取代基
(6)写出下列化学反应方程式:
反应③___________,D与新制Cu(OH)2悬浊液反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
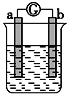
A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础](15分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
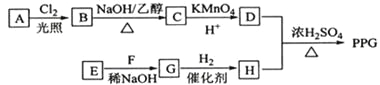
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]() 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图中所示装置进行实验,不能得出相应现象的是( )
选项 | 溶液① | 固体② | 溶液③ | 实验现象 |
|
A | 浓氨水 | 碱石灰 | 酚酞试液 | 酚酞试液变红 | |
B | 浓盐酸 |
|
| 产生淡黄色沉淀 | |
C | 浓硝酸 |
|
| 试管上方产生红棕色气体 | |
D | 稀硫酸 |
|
| 产生白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的紫色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)![]() 原子的结构示意图为 _____,YX3的化学式为 _____。
原子的结构示意图为 _____,YX3的化学式为 _____。
(2)![]() 、Q、R原子的半径从大到小的顺序是 ___________。
、Q、R原子的半径从大到小的顺序是 ___________。![]() 用原子符号表示
用原子符号表示![]() 。
。
(3)![]() 分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
(4)能证明R的非金属性比Q强的实验事实是______![]() 填字母序号
填字母序号![]() 。
。
A HR的水溶液酸性比H2Q的水溶液酸性强 B R2与H2化合比Q与H2化合容易。
C R的最高价氧化物的水化物的酸性比Q的强 D HR的稳定性比H2Q强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO![]() 等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作①过滤②加适量盐酸③加过量的NaOH和Na2CO3混合溶液④加入过量BaCl2溶液。上述4项操作的正确顺序为( )
A.②①③④B.④②③①
C.④③①②D.②③④①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com