
 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。| A.1、2、2 | B.3、1.5、1 | C.3、0、0 | D.0、6、5 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答: _KB(填“>”、“<”或“=”)。
_KB(填“>”、“<”或“=”)。 施为__________。
施为__________。 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占
时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 的比例较大。
的比例较大。
| | 容器A | 容器B |
| M(平) | 20 | |
| 平衡时N2的转化率 | | 10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率( )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”). [B(O
[B(O H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。
FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。 CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
CO(g)+H2O(g) CO2(g)+H2(g) K=1.0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HX(g)的平衡常数为9。若将2.0 mol
HX(g)的平衡常数为9。若将2.0 mol| A.9% | B.18% | C.30% | D.80% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0mol S02 | B.1mol S02 | C.2mol S03 | D.0.3mol O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )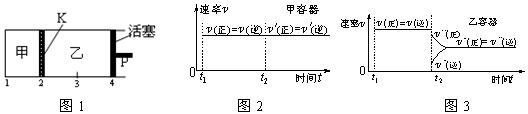
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com