
【题目】I、配平下列方程式:
____MnO![]() +____H++____Cl- === ____Mn2++____Cl2↑+____H2O
+____H++____Cl- === ____Mn2++____Cl2↑+____H2O
____H2S+____HNO3 ===____S↓+____NO↑+____H2O
II、KClO3 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:
2KClO3 +4HCl(浓)=== 2KCl+2ClO2↑+Cl2↑+2H2O
(1)浓盐酸在反应中表现出来的性质是____(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生 0.1molCl2,则转移电子的物质的量为____mol。
(3)用单线桥法标出该反应的电子转移的方向和数目。____
【答案】 2 16 10 2 5 8 3 2 3 2 4 ② 0.2 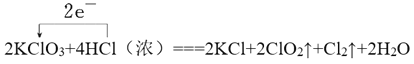
【解析】I、反应中Mn元素化合价从+7价降低到+2价,得到5个电子。Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒、原子守恒以及电荷守恒可知配平后的方程式为2MnO4-+16H++10Cl-===2Mn2++5Cl2↑+8H2O;反应中S元素化合价从-2价升高到0价,失去2个电子,N元素化合价从+5价降低到+2价,得到3个电子,根据电子得失守恒、原子守恒以及电荷守恒可知配平后的方程式为3H2S+2HNO3===3S↓+2NO↑+4H2O;
II、(1)盐酸中氯元素化合价从-1价升高到0价,失去1个电子,同时还有氯化钾生成,因此浓盐酸在反应中表现出来的性质是还原性和酸性,答案选②;(2)氯酸钾中氯元素从+5价降低到+4价,所以氯气是氧化产物,根据方程式可知产生0.1molCl2,转移电子的物质的量为0.2mol。(3)根据以上分析可知单线桥法标出该反应的电子转移的方向和数目为 。
。


科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题:

(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择_________(填序号);若用I装置制取氯气,则浓盐酸应盛放在__________(填I中的仪器名称)。写出实验室制取氯气的化学方程式_________________________________________。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从__________口通入。
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到氢氧化钠溶液中,其发生反应的离子方程式为________________________________________。
(4)气体的吸收:若标准状况下1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为________mol/L。(保留一位小数)

(5)实验室用右图装置(夹持及加热仪器已略)制备氯气并进行一系列相关实验。
①装置B中饱和食盐水的作用是___________;
②设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为___________色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是溶液分为两层,下层为 ___________色
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用48mL0.1mol/L的FeSO4溶液,恰好还原2.4×10-3mol[RO(OH)2]+ 离子,则R元素的最终价态为:( )
A. +2 B. +4 C. +5 D. +3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. 硫酸铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-===Fe(SCN)3
B. 少量SO2气体通入足量的NaClO溶液中:SO2+H2O+ClO-===Cl-+SO![]() +2H+
+2H+
C. 硫酸氢钠溶液中滴加氢氧化钡溶液至中性:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
D. 含0.03 mol NaHCO3的溶液和0.02 mol Ca(OH)2的溶液混合:3HCO![]() +2Ca2++3OH-===CO
+2Ca2++3OH-===CO![]() +2CaCO3↓+3H2O
+2CaCO3↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是_________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。
(4) 用双线桥法表示该反应的电子转移的方向和数目
_____
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
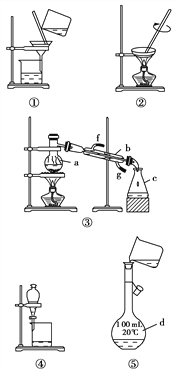
(1)写出上述五种实验操作的名称______________________________。
(2)写出图中字母所示的仪器的名称:a______,b___________, c________,d________。
(3)“粗盐提纯”实验中用到上述装置中的 ________(填序号)。
(4)若利用装置③分离乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物,还缺少的仪器有________,将仪器补充完整后进行的实验操作的名称为________;实验时仪器b中冷却水的进口为________(填“f”或“g”)。
(5)实验室现需要450 mL 0.1 mol/L的Na2CO3溶液,则需要用天平称量________g Na2CO3·10H2O固体;上图中的⑤是某同学转移溶液时的示意图,图中有两处错误分别是____________________________、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于( )
A.纤维素、油脂B.橡胶、油脂C.纤维素、蛋白质D.淀粉、蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com