
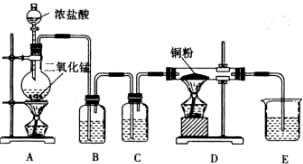
 MnCl2+Cl2↑+ H2O
MnCl2+Cl2↑+ H2O MnCl2+Cl2↑+ H2O。
MnCl2+Cl2↑+ H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:实验题
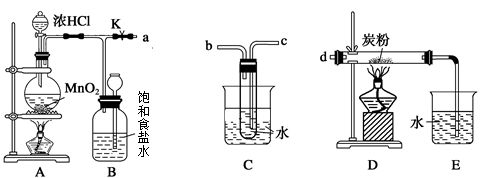
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气有毒,可以毒死细菌、病毒 |
| B.氯气具有刺激性气味,可以熏死细菌、病毒 |
| C.氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 |
| D.氯气用于自来水消毒的工艺简单、成熟,易于操作,且成本低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl2 | B.Na2SO3 | C.NaOH | D.AlCl3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
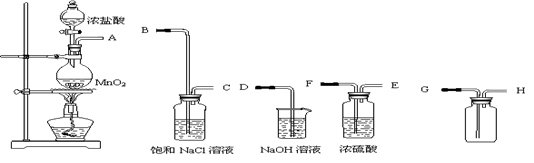
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.立刻褪色 | B.慢慢褪色 | C.先褪色,后复原 | D.颜色不褪 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
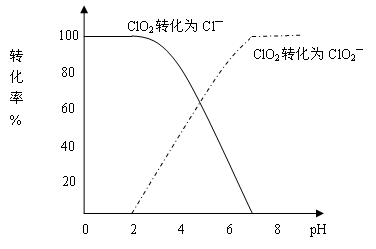
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com