
| A、Q1+Q 3 |
| B、Q1+Q2>2Q3 |
| C、Q1+Q2<Q3 |
| D、Q1+Q2<2Q3 |


科目:高中化学 来源: 题型:
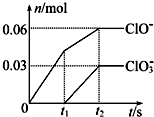 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21 mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量为5.04g |
| D、反应中氧化剂和还原剂的物质的量之比为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH属于强电解质是因为其可以完全电离 |
| B、电解质溶液可以导电是因为溶液中存在自由移动的离子 |
| C、工业上用电解熔融的氯化铝来制备金属铝 |
| D、碳酸钠溶液与澄清石灰水反应的离子方程式可表示为:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH=4 |
| B、此溶液中,HA约有0.1%发生电离 |
| C、加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
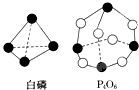 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ?mol-1、E(P-O)=360kJ?mol-1、E(O=O)=498kJ?mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ?mol-1、E(P-O)=360kJ?mol-1、E(O=O)=498kJ?mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(2)(6) |
| B、(1)(2)(4)(6) |
| C、(2)(6) |
| D、(2)(4)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com