
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
分析 食用菜籽油和水互不相溶,可用分液的方法分离,以此解答.
解答 解:A.过滤可以把不溶于液体的固体物质和液体分离,食用菜籽油和水是互不相溶的液体,不能用过滤的方法,故A错误;
B.蒸馏通常用于分离提纯沸点差别较大的互溶的混合化合物,食用菜籽油和水沸点相差较小,且不互溶,故B错误;
C.食用菜籽油和水两种物质互不相溶,分层,可用分液的方法进行分离,下层液体水先从分液漏斗中流出,上层液体食用菜籽油从上口倒出,故C正确;
D.结晶是利用混合物中各成分在同一种溶剂里溶解度的不同或在冷热情况下溶解度显著差异,而采用结晶方法加以分离的操作方法,故D错误;
故选C.
点评 本题考查混合物的分离、提纯,侧重除杂和分离的考查,把握物质的化学性质为解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同位素 | B. | 氘(D)原子核外有1个电子 | ||
| C. | H与 D中子数不同 | D. | H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

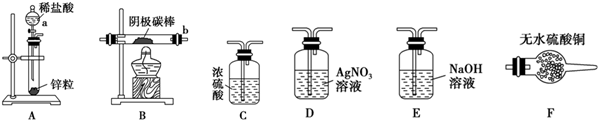
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
查看答案和解析>>
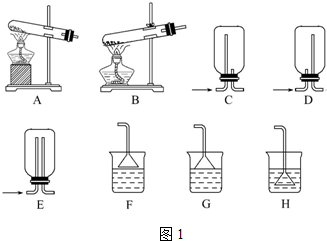
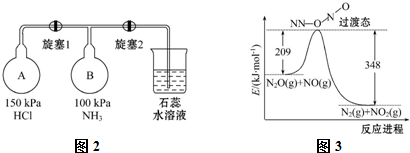
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com