
【题目】将9.2g金属钠投入足量重水(D2O)中,则产生的气体中含有( )
A.0.2 mol中子B.0.2 mol质子C.0.4 mol电子D.0.4 mol分子
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
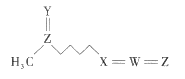
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学试剂氨基氰(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关氨基氰说法正确的是( )

A.属于不饱和烃B.分子中所有原子共面
C.水溶性较好D.能发生取代、加成、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
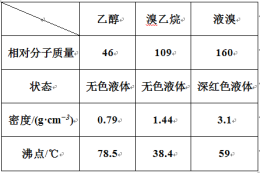
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
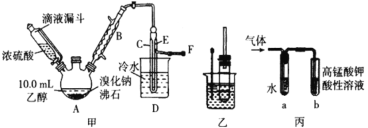
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m![]() 6
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1molL-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中![]() __(填“增大”、“减小”或“不变”)。
__(填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amolL-1,则c(SO42-)=__。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答有关问题:
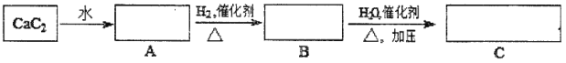
(1)A→B的反应类型是___________,实验室制取B的反应条件是________________。
(2)A和氯化氢为原料可以制得塑料聚氯乙烯。写出制备过程中最后一步发生的方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com