
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
分析 A.同主族金属性从上到下逐渐增强,金属键减弱;
B.离子晶体由阳离子和阴离子构成;
C.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小;
D.非金属性越强,最高价氧化物对应的水化物的酸性越强.
解答 解:A.同主族金属性从上到下逐渐增强,金属键减弱,故同主族金属元素的原子半径越大熔点越低,故A错误;
B.离子晶体由阳离子和阴离子构成,所以在晶体中只要有阴离子就一定有阳离子,属于离子晶体,故B正确;
C.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小,如第三周期中铝离子半径最小,故C错误;
D.非金属性越强,最高价氧化物对应的水化物的酸性越强,则同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,而HClO、亚硫酸等为弱酸,但不是最高价含氧酸,故D错误.
故选B.
点评 本题考查元素周期律、晶体的构成微粒,把握元素的位置及性质变化规律为解答的关键,把握元素金属性、非金属性比较即可解答,题目难度不大.


科目:高中化学 来源: 题型:推断题
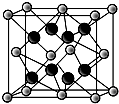 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题: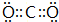 或
或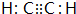 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质 | |
| B. | 强电解质溶液的导电能力可能比弱电解质溶液导电能力弱 | |
| C. | Cu、NaCl溶液不是电解质,所以是非电解质 | |
| D. | SO3溶于水后导电,所以SO3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
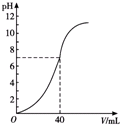 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
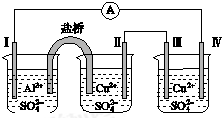
| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H2SO40.2mol的浓硫酸与足量的Cu反应可产生SO2分子数为0.1NA | |
| B. | 足量Fe与1 mol氯气反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4LSO3含有分子的数目为NA个 | |
| D. | 1molNa2O2所含离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
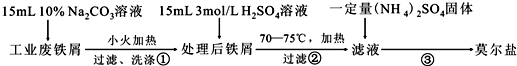
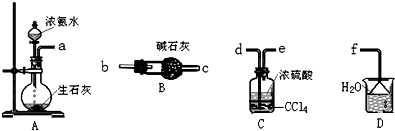
 案.
案.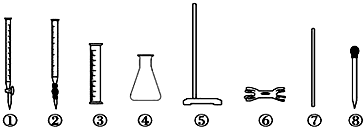
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com