
【题目】[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
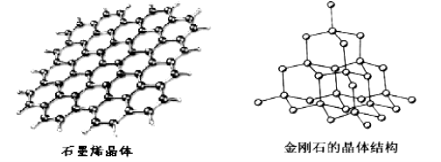
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
【答案】(1)电子云
(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构
(3)σ键、π键 sp CO2、CS2、HCN或COS等
(4)1s22s22p63s23p63d64s2(或[Ar]3d64s2) 分子
(5)① 3 2 ② 12 4
【解析】
试题分析:(1)电子在原子核外出现的概率密度分布可用电子云描述;(2)C有4个价电子且半径较小,难以通过得或失电子达到稳定结构,所以碳在形成化合物时,其键型以共价键为主;(3)C2H2 分子的结构式为![]() ,共价键的类型有σ键、π键;乙炔为直线型分子,C 原子的杂化轨道类型是sp;CO2、CS2都是直线型;( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布1s22s22p63s23p63d64s2(或[Ar]3d64s2);Ni(CO)4,熔沸点低,推测Ni(CO)4是分子晶体。(5)①根据图示,石墨烯晶体中,每个C 原子连接3个六元环;根据均摊法,每个六元环占有
,共价键的类型有σ键、π键;乙炔为直线型分子,C 原子的杂化轨道类型是sp;CO2、CS2都是直线型;( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布1s22s22p63s23p63d64s2(或[Ar]3d64s2);Ni(CO)4,熔沸点低,推测Ni(CO)4是分子晶体。(5)①根据图示,石墨烯晶体中,每个C 原子连接3个六元环;根据均摊法,每个六元环占有![]() =2个C 原子;②根据图示,在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面。
=2个C 原子;②根据图示,在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面。


科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。比如:

(1)上图所示的物质分类方法名称是 ;
(2)按上述分类法,下列物质中Fe、O2、H2SO4、Ba(OH)2、Ca(HCO3)2、SO2属于酸的是__________,这些物质间有的可发生化学反应,请写出一个属于置换反应的离子方程式:___________________;
人们利用分类法对化学物质和化学反应进行分类学习,例如CO2属于二元弱酸的酸性氧化物,Ca(OH)2属于强碱,已知将过量CO2缓缓通入澄清石灰水中,溶液先变浑浊,后又变澄清;NaOH也属于强碱,请写出:
少量CO2与NaOH溶液反应的离子方程式:____________________________;
过量CO2与NaOH溶液反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
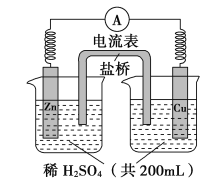
(1)原电池的负极反应是______________________,
正极反应是__________________________。
(2)电流的方向是_____________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗________g锌,有____________个电子通过了导线,原硫酸的物质的量浓度是_____________(设溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容下的反应:2AB(g)![]() 3A2(g)+B2(g),能说明此反应达到平衡是
3A2(g)+B2(g),能说明此反应达到平衡是
A.混合气体的平均摩尔质量不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成3nmolA2,同时消耗2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了( )
A.该反应是吸热反应 B.铁粉和硫粉在常温下可以发生反应
C.该反应是放热反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
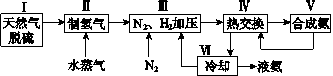
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.4kJ·mol-1
CO(g)+3H2(g)△H=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ·mol-1
CO2(g)+H2(g)△H=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为__________。
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
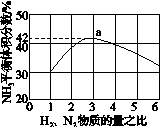
(a)(b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com