
| A、3.01×1023 |
| B、6.02×1023 |
| C、3.01×1022 |
| D、6.02×1022 |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、42He原子核内含有 4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以He很容易失去电子,具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| B、NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
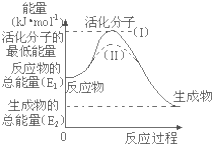 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
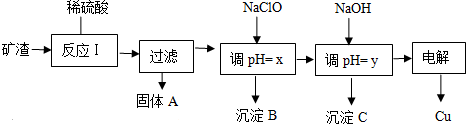
查看答案和解析>>
科目:高中化学 来源: 题型:
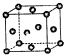 已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.
已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.查看答案和解析>>
科目:高中化学 来源: 题型:
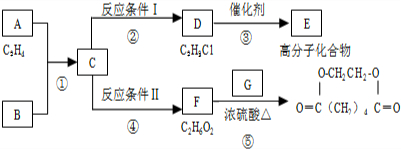
查看答案和解析>>
科目:高中化学 来源: 题型:
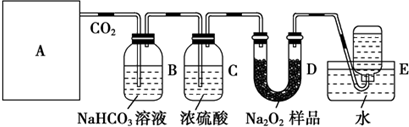
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同. | 温度 (℃) | 乙醇转化率 (%) | 有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com