
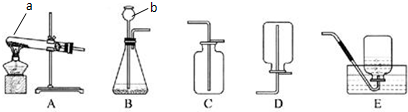
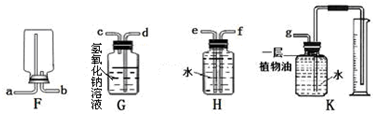
分析 (1)依据仪器的形状说出其名称;
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气,依据反应物状态和反应条件选择发生装置;氧气密度大于空气密度,难溶于水,据此选择发生装置;
(3)①依据氧气密度大于空气密度,应采用向上排空气法收集,据此确定氧气的入口;
②二氧化碳能够与氢氧化钠反应,能够溶于水,不溶于植物油,据此解答;
③依据二氧化碳能够与氢氧化钠反应,一氧化碳不溶液水,不能与氢氧化钠溶液反应的性质解答;
解答 解:(1)依据仪器形状可知:a试管 b长颈漏斗;
故答案为:试管;长颈漏斗;
(2)高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气,方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;反应物状态为固体,反应条件为加热,所以应选择装置A作为发生装置;氧气的密度比空气大,不易溶于水,可以选择向上排空气法或者排水法收集,故选用的收集装置是C或E;
故答案为:A; C或E;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)①氧气密度大于空气密度,采用向上排空气法收集,用F装置收集氧气,则氧气应从b口进入;
故答案为:b;
②二氧化碳能够与氢氧化钠反应,能够溶于水,所以不能G、H装置,二氧化碳不溶于植物油,可以用排植物油法收集测量二氧化碳体积;
故答案为:K;
③二氧化碳能够与氢氧化钠反应,一氧化碳不溶液水,不能与氢氧化钠溶液反应,所以可以用盛有氢氧化钠溶液的H装置除去一氧化碳中少量的二氧化碳;
故答案为:H.
点评 本题考查了常见气体制备装置选择,明确反应原理,物质的状态和反应条件即可确定反应的发生装置,依据气体的密度、水溶性选择收集方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
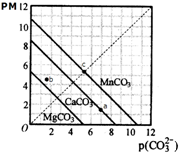
| A. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
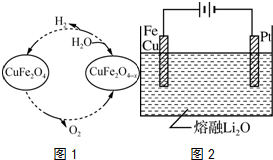
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
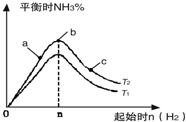
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
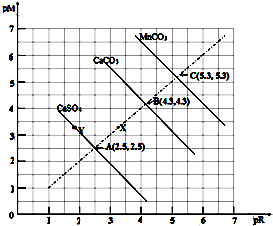
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
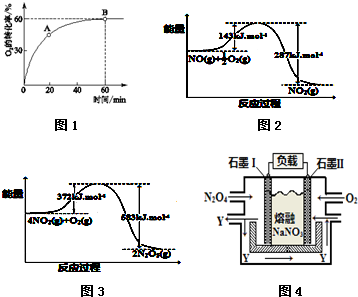
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com