
【题目】铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________(填符号)。
(2)基态Cr原子价层电子的电子排布式为________,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________。写出一种与SCN-互为等电子体的分子的化学式________。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________。
(5)由于晶体缺陷,Ni的某种氧化物的化学式为Ni0.88O,则该晶体中Ni2+和Ni3+最简整数比为________。
(6)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

①C60分子中碳原子的杂化方式为________。
②该超导体晶胞中,K+填充在由C60围成的________空隙和________空隙中。
③若晶胞中A的坐标参数为(0,0,0),B的坐标为(1,1,1),则与A距离最近的K+的坐标参数为________。
【答案】N 3d54s1 s、ds 离子键、共价键、配位键 N2O、CO2、CS2、COS Ni2+半径比Fe2+小,NiO的晶格能比FeO大 8:3 sp2 正四面体 正八面体 (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)根据元素原子核外电子层数分析判断;
(2)根据Cr原子核外电子排布式分析判断;
(3)根据K3Fe(SCN)6的结构分析存在的作用力的类型;结合等电子体概念判断;
(4)从离子晶体的晶格能大小分析判断;
(5)根据NixO中化合价代数和为零可求得晶体中Ni2+与Ni3+的最简整数比;
(6)①根据价层电子对互斥理论判断C60中C原子杂化方式;
②根据图知,K+占据的是C60围成的正四面体空隙和正八面体空隙;
③若C60分子的原子坐标参数分别为A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),说明该晶胞的棱长是1,则距离A位置C60分子最近的K+为形成的正四面体体心上的分析。
(1)Fe、Cr、Ni的基态原子核外有4个电子层,所以Fe、Cr、Ni的基态原子核外电子占据的最高能层为N层;
(2)Cr元素是24号元素,其原子核外有24个电子,根据构造原理可知其原子的电子排布式为1s22s22p63s23p63d54s1,原子在参加化学反应时,最外层的4s电子及3d轨道上的电子都有可能失去,所以Cr原子的价层电子的电子排布式为:3d54s1;与Cr同周期且基态原子最外层电子数相同的元素有K和Cu,二者分别位于周期表的s区和ds区;
(3)K3Fe(SCN)6内部的作用力有离子键、共价键、配位键;SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为N2O、CO2、CS2、COS等;
(4)FeO、NiO的晶体结构均为NaCl型,说明二者都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比,Ni2+半径比Fe2+小,NiO的晶格能比FeO大,所以NiO的熔点高于FeO;
(5)设晶体中Ni2+与Ni3+的最简整数比为x:y,根据NixO中化合价代数和为零可知:![]() ×0.88=2,解得x:y=8:3;
×0.88=2,解得x:y=8:3;
(6)①C60中每个C原子连接3个碳原子,每个C原子形成2个C-C单键、1个C=C双键,C原子杂化轨道数目为3,C原子采取sp2杂化;
②根据图知,该超导体晶胞中,K+占据的是C60围成的正四面体空隙和正八面体空隙;
③若晶胞中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),说明该晶胞的棱长是1,则与A距离最近的K+位于C60形成的正四面体体心上,故其坐标参数为(![]() ,
,![]() ,
,![]() )。
)。


科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A.图中T1<T2
B.M区域内任意点均有c(H+)<c(OH-)
C.两条曲线间任意点均有c(H+)·c(OH-)=Kw
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是制备其他含铜化合物的重要原料。有以下三种制备硫酸铜的途径,下列说法
不正确的是
途径①:Cu![]() CuSO4
CuSO4
途径②:Cu![]() CuSO4
CuSO4
途径③:Cu![]() CuSO4
CuSO4
A.途径①中浓硫酸体现强氧化性和酸性
B.途径①中,100g98%的浓H2SO4与足量铜反应,可得到80gCuSO4
C.途径②所用混酸中硝酸与硫酸物质的量之比最好为2:3
D.相对于途径①和途径②,途径③更好的体现了绿色化学的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A的产量可以用来衡量一个国家的石油化工发展水平,它的聚合反应制品在现代日常生活中用途很广。一定条件下,A与水反应生成B,B俗称酒精。B在铜或银等催化剂存在下可以被氧气氧化为C,还可以与酸性高锰酸钾溶液反应被直接氧化为D,B和D一定条件下反应的产物E可用作饮料、糖果、香水和化妆品中的香料。
回答下列问题:
(1)A分子中官能团的名称是___,A与足量氢气加成后产物F的分子式为___,和F互为同系物的物质中碳原子数为4的有机物其一氯代物有___种。
(2)写出B和D反应生成E的化学方程式为___,该反应的反应类型为___。
(3)B可用于燃料电池,若用NaOH作电解质溶液,负极电极反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
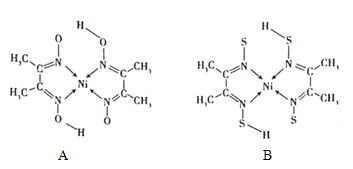
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
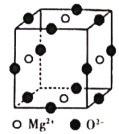
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质间常常相互联系、互相影响中,微粒也不例外。下列各组离子可能大量共存的是![]()
A.常温下水电离出的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.不能使酚酞试液变红的无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
C.能与金属铝反应放出氢气的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.无色透明溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)![]() C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。

(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A.电池工作时质子通过交换膜由负极区向正极区移动
B.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
C.阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
D.相比现有工业合成氨,该方法条件温和,同时还可提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
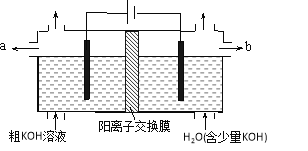
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com