
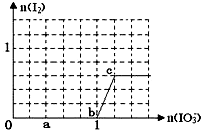
 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:| 1 |
| 5 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 盐酸的浓度/mol?L-1 | 滴定完成时,盐 酸滴入的体积/mL | 待测NaOH溶液 的体积/mL |
| 1 | 0.1152 | 26.72 | 25.00 |
| 2 | 0.1152 | 29.02 | 25.00 |
| 3 | 0.1152 | 26.70 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④⑥ |
| C、①③④ | D、①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A、X与Y可以形成阴离子XY32- |
| B、元素R的含氧酸一定为强酸 |
| C、Z的氢化物的沸点比T的氢化物的沸点高 |
| D、由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com