
【题目】写出下列物质的分子式或结构简式:
(1)1L烷烃C的蒸气完全燃烧时,生成同温同压下15L水蒸气:__________。
(2)分子式为CmH20的烷烃中m为________。
(3)碳、氢原子个数之比为2∶5的烷烃的分子式为__________,它的同分异构体的结构简式为__________。
【答案】CH3(CH2)12CH3 9 C4H10 CH3CH2CH2CH3、CH(CH3)3
【解析】
(1)1L烷烃完全燃烧生成15L的水蒸气,根据阿伏伽德罗定律的推论,同温同压下气体体积比等于物质的量的比可以得出,1mol烷烃C完全燃烧生成15mol水蒸气,故烷烃C中含有2×15=30mol的氢原子,根据烷烃通式CnH2n+2,该烷烃的分子式为C14H30,结构简式为CH3(CH2)12CH3;
(2)根据烷烃通式,分子式为CmH20的烷烃为C9H20,m=9;
(3)碳、氢原子个数比为![]() ,解得n=4,则该烷烃的分子式为C4H10,其有2种同分异构体,结构简式分别为CH3CH2CH2CH3、CH(CH3)3。
,解得n=4,则该烷烃的分子式为C4H10,其有2种同分异构体,结构简式分别为CH3CH2CH2CH3、CH(CH3)3。


科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱氢来制取苯乙烯:
![]() (g)
(g)![]() (g)+H2(g) H=117.6kJ/mol
(g)+H2(g) H=117.6kJ/mol
已知:上述反应的速率方程为v正=k正P乙苯,v逆=k逆P苯乙烯P氢气,其中k正、k逆分别为正、逆反应速率常数,P为各组分分压。
(1)同时增大乙苯的反应速率和平衡转化率所采取的措施是_______________。
(2)在CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两种途径:
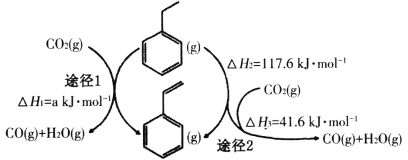
a=______;与掺水蒸汽工艺相比,该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填序号)。
a.CO2与H2反应,使乙苯脱氢反应的化学平衡右移
b.不用高温水蒸气,可降低能量消耗
c.有利于减少生产过程中可能产生的积炭
d.CO2在反应体系中作催化剂
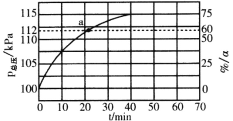
(3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀释剂能提高乙苯转化率的原因是_______________。测得容器总压(P总)和乙苯转化率α随时间变化结果如图所示。平衡时,P(H2O)=_______kPa,平衡常数Kp=____kPa(用平衡分压代替平衡浓度计算);a处的![]() =_________。
=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28g晶体硅中,含Si﹣Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C﹣C键键能小于Si﹣Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式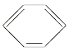 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
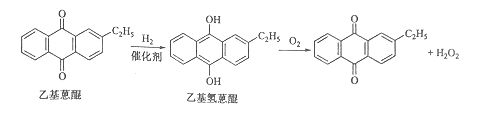
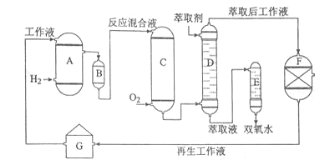
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.回答下列问题:
(1)化学式C6H12的烯烃的所有碳原子在同一平面上,则该烯烃的结构简式为___________
(2)1mol ![]() 能与__________mol NaHCO3反应
能与__________mol NaHCO3反应
(3)香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
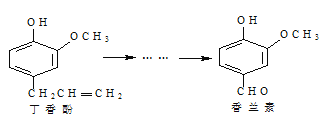
①常温下,1摩丁香酚能与_____________mol Br2反应
②香兰素分子中至少有_________________个原子共平面
II.由 ![]()
![]()
制对甲基苯乙炔的合成路线如下:
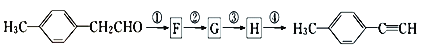
(G为相对分子质量为118的烃)
(1)写出G的结构简式_________________
(2)①的反应类型______________
(3)④的反应条件_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
选项 | a(干燥气体) | b(液体) |
|
A | NO2 | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
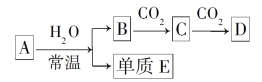
(1)若A为金属钠,A与水反应的离子方程式为_______________。
(2)若A为淡黄色的固体化合物,A________(填“是”或“不是”)碱性氧化物,A与CO2反应的化学方程式为_________________。
(3)A不论是Na还是淡黄色的固体化合物,依据转化关系判断物质C是________,物质D是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大, X、Z、W 均可形成酸性氧化物。X的一种氢化物分子空间构型为三角锥型,YW是氯碱工业的主要原料,Z的最外层电子数为4,请回答以下问题:
(1)表示氯碱工业生产原理的化学方程式为____________________________________。
(2)X的另一种氢化物X2H4可作为火箭推进器燃料,其结构式为__________________ 。
(3)Y的氧化物中,有一种既含离子键又含共价键,该氧化物的电子式为 ___________。
(4)Z的氧化物属于晶体,工业制备Z单质的化学方程式为________________________。
(5)W单质是毒性很大的窒息性气体。工业上用X气态氢化物的浓溶液检验W单质是否泄露,写出反应的化学方程式_________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com