
英国物理学家约翰·丁达尔首先发现了入射光透过胶体时,从侧面可以看到一条光亮的通路。下列液体中,不会出现丁达尔效应的分散系是 ( )。
①鸡蛋白溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 ⑤沸水中滴入饱和FeCl3溶液 ⑥肥皂水
A.② B.①③ C.⑤⑥ D.④
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
最新的病毒学研究证实,NO对SARS病毒有直接抑制作用.下列关于NO的叙述正确的( )
A.NO是一种红棕色的气体 B、常温常压下,NO不能与O2直接化合
C.NO可由N2和O2在放电条件下直接化合得到 D、NO易溶于水,不能用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(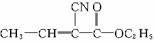 )涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料。这种化合物是由三种单体合成的。试回答:
)涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料。这种化合物是由三种单体合成的。试回答:
(1)合成化合物A的三种单体是HCN、__________、__________(用结构简式表示)。
(2)写出A发生固化的反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
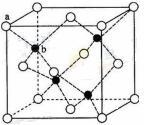
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度来看,不恰当的一种物质是________。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式_______________
_____________ _________________________________________________。
_________________________________________________。
(3 )“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Ag B.Cu C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①________;②Na2CO3;③________;④NaHCO3。
将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
①1 mol某链烃最多能和2 mol HCl发生加成反应,生成1 mol氯代烷;②1 mol该氯代烷能和8 mol Cl2发生取代反应,生成只含碳元素和氯元素的氯代烃。该链烃可能是 ( )。
A.CH3CH===CH2  B.CH2===CHCH===CH2
B.CH2===CHCH===CH2
C.CH3CH===CHCH3 D.CH3C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧
热为-Y kJ/mol,则C与1mol O2反应生成CO时的反应热△H为 ( )
A-Y kJ/mol B-(10X-Y)kJ/mol C-(5X-0.5Y)kJ/mol D+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是___ ____。
(2)为便于储存,要将氯气液化[ Cl2(g) 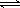 Cl2(l) ],
Cl2(l) ],
应采取的措施是__ _____(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |
|
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的
作用____ ___。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
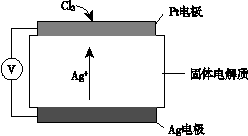
Cl2在Pt电极放电的电极反应式是__ _____。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:
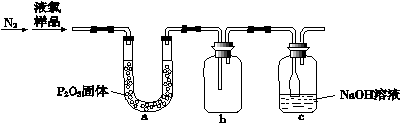
(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用___ ____。
② 检测液氯的含水量,根据上图,需要测定的数据
是___ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com