
| A. | 减小压强 | B. | 降低温度 | ||
| C. | 增大O2浓度 | D. | 使用合适的催化剂 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.3×1023 | B. | 3.3×1024 | C. | 7.5×1023 | D. | 7.5×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2O 的物质的量之比为1:2 | |
| B. | 产生的NO的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol/L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
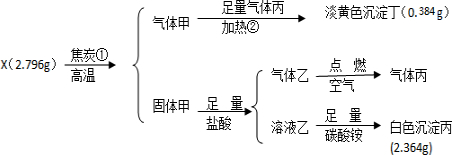
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液未呈血红色,说明稀硝酸不能将Fe氧化为Fe3+ | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 | |
| C. | 比较Fe(OH)3和Al(OH)3的Ksp:向0.1mol•L-1的FeCl3溶液中滴加0.1mol•L-1氨水至不再产生沉淀,然后再滴入0.1mol•L-1A1Cl3溶液,观察现象 | |
| D. | 验证氧化性Fe3+<Br2<Cl2;向试管中依次加入1mL0.1mol•L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机层和水层中的现象. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com