
| A. | 2.24LCO2中含0.3NA原子 | |
| B. | 0.3molNH4NO3固体中含0.3NANH4+ | |
| C. | 5.6g铁粉完全反应一定失去0.3NA电子 | |
| D. | 25℃,0.1NAHCl气体溶于1L水,溶液pH=1 |
分析 A.CO2所处的状态不明确;
B.1个NH4NO3固体中含1个铵根离子和1个硝酸根离子;
C.铁被硝酸氧化一定是得到三价铁,但铁过量时会把三价铁还原为二价铁分析判断;
D.25℃,0.1NAHCl气体溶于1L水,溶液体积大于1L.
解答 解:A.CO2所处的状态不明确,故其物质的量和原子个数无法计算,故A错误;
B.1个NH4NO3固体中含1个铵根离子和1个硝酸根离子,0.3molNH4NO3固体中含0.3NANH4+,故B正确;
C..6g铁物质的量为0.1mol,与过量的硝酸反应一定生成三价铁离子,电子转移为0.3mol,若铁过量,铁会和三价铁离子反应生成亚铁离子,电子转移为0.2mol,故C错误;
D.25℃,0.1NAHCl气体物质的量为0.1mol,溶于1L水,溶液体积大于1L,氢离子浓度小于0.1mol/L,故溶液PH不是1,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

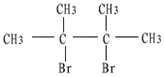
 ,反应类型:消去反应;
,反应类型:消去反应;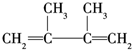 +Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.
+Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①说明水解反应为放热反应 | B. | ③说明水解反应为吸热反应 | ||
| C. | ①中溶液红色变浅 | D. | ③中溶液红色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质颗粒直径都在1nm~100 nm之间 | |
| B. | 能透过半透膜 | |
| C. | 都有丁达尔效应 | |
| D. | 呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氯气通入NaOH溶液中:2OH-+Cl2═Cl-+ClO-+H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | AlC13溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaF2难溶于水,其水溶液的导电性极弱 | |
| B. | CaF2的熔、沸点较高,硬度较大 | |
| C. | CaF2固体不导电,但在熔融状态下可以导电 | |
| D. | CaF2在有机溶剂(如苯)中的溶解度极小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com