
有关金属的腐蚀与防护的叙述正确的是( )

A.金属的化学腐蚀比电化学腐蚀普遍
B.上图装置的原理是“牺牲阳极的阴极保护法”
C.金属腐蚀的本质是M-ne-===Mn+而被损耗
D.用铝质铆钉来接铁板,铁板易被腐蚀
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
龙葵醛(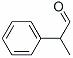 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
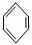





龙葵醛
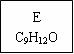


(1)龙葵醛的分子式为 ,其中含氧官能团的名称是 ;
A物质得到的1H-NMR谱中有 个吸收峰,B的结构简式可能为 。
(2)反应③的反应类型为 ,反应⑤的反应条件为 。
(3)反应⑥的化学方程式为 。
(4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):
查看答案和解析>>
科目:高中化学 来源: 题型:
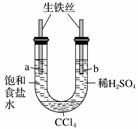 利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
将烧碱吸收H2S后的溶液加入如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:

S2--2e-===S (n-1)S+S2-===S
①写出电解时阴极的电极反应式:____________________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
截至到2013年12月末,中国光伏发电新增装机容量达到10.66 GW,光伏发电累计装机容量达到17.16 GW,图为利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
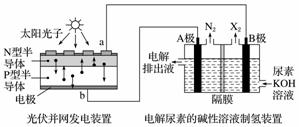
下列叙述中正确的是( )
A.N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-===CO +N2↑+6H2O
+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:________________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为___________________。
若以该电池为电源,用石墨作电极电解100 mL含有以下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请回答有关问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 2 | ① | ② | ③ | |||||||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||
| 4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)④元素与⑦元素形成化合物的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是___________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为__________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com