
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98g |
| B、摩尔是物质质量的单位 |
| C、氮原子的质量就是氮的相对原子质量 |
| D、氧气的摩尔质量(单位:g?mol-1)在数值上等于它的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图提供的信息,下列所得结论不正确的是( )
根据如图提供的信息,下列所得结论不正确的是( )| A、该反应为放热反应 |
| B、该反应一定有能量转化成了化学能 |
| C、反应物比生成物稳定 |
| D、因为生成物的总能量高于反应物的总能量,所以该反应不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
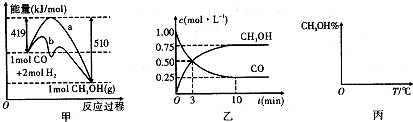
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com