考点:位置结构性质的相互关系应用,配合物的成键情况
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)同周期自左而右元素电负性增大,且元素非金属性越强电负性越大;结合能量最低原理、泡利不相容原理和洪特规则书写电子排布图;
(2)根据N原子的价电子排布式2s
22p
3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp
3杂化,如NH
3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp
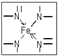
2杂化,如本题中的

,若都为单键,则该氮原子为sp
3杂化;
(3)N
2H
4分子中含有4个N-H键,若该反应中有4mol N-H键断裂,则参加反应的N
2H
4为1mol,计算生成氮气的物质的量,每个氮气分子含有2个π键,进而确定形成π键物质的量;
(4)CN
-与N
2互为等电子体,故CN
-中C原子与N原子之间形成三对共用电子对;O
22+与N
2互为等电子体,二者结构相似,氧原子之间形成O≡O三键;
(5)A.同周期自左而右元素第一电离能呈增大趋势,但处于半满、全满、全空时能量最低,元素第一电离能较高;
B.同主族自上而下,金属性增强;
C.同主族自上而下非金属性减弱,非金属性越强,与氢气反应更容易;
D.同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强.
解答:
解:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,且元素非金属性越强电负性越大,故H的电负性最小;基态Fe原子的核外价电子排布式为[Ar]3d
64S
2,
故答案为:H;[Ar]3d
64S
2;
(2)根据N原子的价电子排布式2s
22p
3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp
3杂化,如NH
3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp
2杂化,如本题中的

,若都为单键,则该氮原子为sp
3杂化,如NH
4+,
故答案为:sp
2、sp
3;
;
(3)N
2H
4分子中含有4个N-H键,若该反应中有4mol N-H键断裂,则参加反应的N
2H
4为1mol,生成氮气的物质的量为1mol×
=1.5mol,每个氮气分子含有2个π键,故形成π键物质的量=1.5mol×2=3mol,
故答案为:3mol;
(4)CN
-与N
2互为等电子体,故CN
-中C原子与N原子之间形成三对共用电子对,其电子式为:
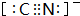
,O
22+与N
2互为等电子体,二者结构相似,氧原子之间形成O≡O三键,故1mol O
22+中含有的π键数目为2N
A,
故答案为:
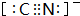
;2N
A;
(5)A.P和S属于第三周期元素,同周期自左而右元素第一电离能呈增大趋势,但P元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于S元素,故A错误;
B.Na和Rb属于第ⅠA族元素,同主族自上而下,金属性增强,故Rb失电子能力比Na强,故B正确;
C.C和Si属于第ⅣA族元素,同主族自上而下非金属性减弱,故C比Si更容易和氢气反应,故C错误;
D.Cl和Br属于第ⅦA族元素,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强,故D错误,
故答案为:B.
点评:本题是对物质结构与性质考查,涉及核外电子排布、化学键、杂化轨道、等电子体、元素周期律等,需要学生熟练掌握基础知识,难度中等.

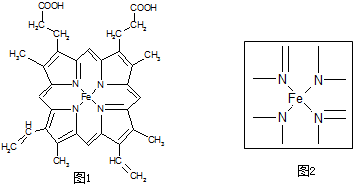
 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化; ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+, ;
;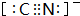 ,O22+与N2互为等电子体,二者结构相似,氧原子之间形成O≡O三键,故1mol O22+中含有的π键数目为2NA,
,O22+与N2互为等电子体,二者结构相似,氧原子之间形成O≡O三键,故1mol O22+中含有的π键数目为2NA, ;2NA;
;2NA;

 (1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示: